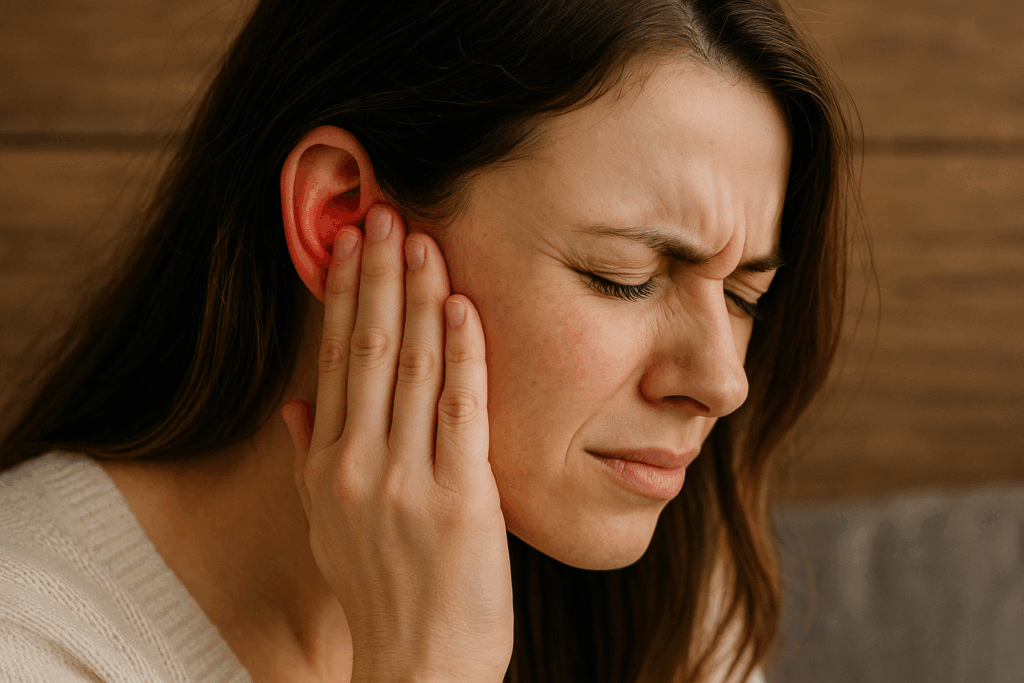
赤ニキビは、医学的には紅色丘疹(こうしょくきゅうしん)または炎症性丘疹と呼ばれ、尋常性ざ瘡における炎症性皮疹の代表的な病型です。赤ニキビは、毛包脂腺系において皮脂の過剰分泌、毛包漏斗部の角化異常、細菌増殖、そして炎症反応という四つの病態生理学的要素が複合的に作用することで形成されます。赤ニキビの本質は、非炎症性病変である面皰が炎症性病変へと移行する過程において、免疫系が活性化され、炎症性メディエーターが大量に放出されることにより、毛包周囲組織に紅斑と腫脹を伴う丘疹が形成される現象です。赤ニキビは直径2〜5mm程度の隆起性病変として視認され、触診では圧痛を伴い、視診では明瞭な紅斑を呈します。炎症の程度により、軽度の赤ニキビから膿疱、さらには結節へと進展する可能性を内包しています。
赤ニキビの形成過程を理解するためには、炎症という現象の本質を把握する必要があります。炎症とは、組織損傷または病原体侵入に対する生体防御反応であり、血管透過性亢進、白血球浸潤、炎症性メディエーター放出を特徴とします。赤ニキビでは、毛包内で増殖した細菌と皮脂分解産物が炎症刺激となり、毛包上皮細胞および周囲組織が自然免疫応答を開始します。この応答過程において、受容体を介したシグナル伝達が活性化され、炎症性サイトカインおよびケモカインが産生されます。これらのメディエーターは血管内皮細胞に作用して血管拡張と血管透過性亢進を引き起こし、その結果として紅斑と浮腫が生じます。さらに、ケモカインは好中球やマクロファージなどの炎症細胞を毛包周囲組織へ動員し、これらの細胞が細菌を貪食するとともに活性酸素種や蛋白分解酵素を放出して組織損傷を引き起こします。したがって、赤ニキビの形成は単なる細菌感染ではなく、複雑な免疫学的カスケードの結果として理解されます。
赤ニキビの臨床的重要性は、その視認性の高さと心理社会的影響の大きさにあります。赤ニキビは顔面に発生することが多く、紅斑を伴うため美容的に目立ちやすく、患者の生活の質に著しい悪影響を及ぼします。ざ瘡は患者の顔面、頸部、胸部、上背部、上腕部に発生し、これらは大型でホルモン応答性の皮脂腺が豊富な部位です。赤ニキビは思春期以降に発症することが多く、ホルモンの影響により皮脂分泌が亢進する時期に一致します。しかし、成人においても赤ニキビは発生し、特に女性では月経周期に関連した周期的な悪化がみられます。赤ニキビを放置すると、炎症が深部へ進展して結節や嚢腫を形成し、最終的には瘢痕や色素沈着などの後遺症を残す可能性があります。したがって、赤ニキビの病態を正確に理解し、早期に適切な介入を行うことは、患者の心理社会的健康を維持するうえで極めて重要です。
ニキビの種類と形成機序
- 白ニキビの病態と形成メカニズム—閉鎖面皰はいかにして生じるのか
- 黒ニキビの病態と形成メカニズム—開放面皰はいかにして生じるのか
- 赤ニキビの病態と形成メカニズム—紅色丘疹はいかにして生じるのか
- 黄ニキビの病態と形成メカニズム—膿疱はいかにして生じるのか
赤ニキビとは何か—炎症性ざ瘡の医学的定義と臨床的特徴
赤ニキビは尋常性ざ瘡における炎症性皮疹の一型であり、炎症性丘疹として医学的に分類されます。この病変は毛包脂腺系において炎症反応が惹起され、毛包周囲組織に紅斑と腫脹を伴う隆起性病変が形成される状態を指します【文献3】【文献4】【文献5】。赤ニキビは皮膚表面に紅色の小丘疹として観察され、その直径は通常2〜5mm程度です。触診では、丘疹に軽度から中等度の圧痛を認め、視診では周囲皮膚と明瞭に区別される紅斑が確認されます。炎症所見を伴うため、紅斑、腫脹、熱感、疼痛という炎症の四徴候のうち少なくとも紅斑と腫脹が観察されます【文献5】。赤ニキビは非炎症性皮疹である白ニキビや黒ニキビとは明確に区別され、炎症の存在が決定的な鑑別点となります【文献2】【文献5】。
赤ニキビの病態を理解するうえで重要なのは、ざ瘡における炎症性病変と非炎症性病変の相違です。非炎症性皮疹である面皰は、毛包内に皮脂と角質が詰まった状態であり、炎症反応を伴いません。面皰とは、毛包内に角質と皮脂が結合して毛包を閉塞した状態です。面皰は開放型として存在するか、皮膚により閉鎖された型として存在します【文献2】。白ニキビは閉鎖面皰と呼ばれ、毛孔が閉鎖されているため白色の小丘疹として視認されます。黒ニキビは開放面皰と呼ばれ、毛孔が開大して内部の皮脂が酸化されることで黒色を呈します【文献2】。これらの非炎症性病変では、紅斑や圧痛などの炎症所見は認められません。しかし、面皰内で細菌が増殖し、毛包壁が破綻すると、毛包内容物が真皮内へ漏出して炎症反応が惹起され、赤ニキビへと進展します【文献3】【文献4】【文献5】。この移行過程において、免疫系が活性化され、炎症性メディエーターが放出されることで、赤ニキビの特徴的な紅斑と腫脹が形成されます【文献3】【文献4】。
赤ニキビの特徴的な紅色は、炎症に伴う血管拡張と血流増加の結果として生じます。炎症性メディエーターが血管内皮細胞に作用すると、血管平滑筋が弛緩して血管が拡張し、毛包周囲組織への血流が増加します【文献3】。増加した血流により、赤血球が組織内に多く供給され、皮膚表面から赤色として視認されます。さらに、血管透過性が亢進することで、血漿成分が血管外へ漏出し、組織浮腫が生じます【文献3】【文献4】。この浮腫により、赤ニキビは隆起性病変として触知されます。炎症の程度が軽度であれば、紅斑と軽度の腫脹のみが観察されますが、炎症が進行すると、好中球が大量に浸潤して膿疱が形成されます【文献5】。膿疱は黄色の膿を含む水疱として視認され、これが黄ニキビと呼ばれる病態です【文献5】。さらに炎症が深部へ進展すると、真皮深層や皮下組織にまで炎症が及び、結節や嚢腫が形成されます【文献5】。このように、赤ニキビは炎症の程度により多様な臨床像を呈します【文献3】【文献4】【文献5】。
赤ニキビの組織学的構造と炎症細胞浸潤の特徴
赤ニキビの組織学的構造は、毛包周囲組織における炎症細胞浸潤と血管拡張を特徴とします。組織学的には、毛包漏斗部に角質栓が認められ、毛包内腔には皮脂、角質、細菌が充満しています。炎症が惹起された毛包では、毛包上皮が部分的に破綻し、毛包内容物が真皮内へ漏出しています【文献4】【文献5】。この漏出に対する反応として、毛包周囲に好中球、リンパ球、マクロファージなどの炎症細胞が浸潤します【文献4】。好中球は炎症の初期段階で最も多く浸潤する細胞であり、細菌を貪食するとともに活性酸素種や蛋白分解酵素を放出します【文献4】。リンパ球は適応免疫応答を担い、特に補助型細胞が炎症性サイトカインを産生して炎症を増幅します【文献4】。マクロファージは貪食作用に加えて、組織修復過程においても重要な役割を果たします【文献4】。これらの炎症細胞の浸潤により、毛包周囲組織は著しく腫脹し、赤ニキビの隆起性病変が形成されます【文献4】【文献5】。
赤ニキビにおける毛包壁の破綻は、炎症惹起の重要な契機となります。正常な毛包では、毛包上皮が完全な障壁として機能し、毛包内容物を真皮から隔離しています。しかし、面皰が形成されると、毛包内圧が上昇し、毛包壁に対する機械的ストレスが増大します【文献5】。さらに、毛包内で増殖した細菌が産生するリパーゼやプロテアーゼなどの酵素が毛包上皮を分解し、毛包壁の脆弱性を増加させます【文献4】。これらの要因により、毛包壁が部分的または完全に破綻すると、毛包内容物が真皮内へ漏出します【文献4】【文献5】。漏出した内容物には、細菌、皮脂分解産物、角質、そして細菌由来の病原体関連分子パターンが含まれており、これらが真皮内で炎症反応を惹起します【文献3】【文献4】。特に、細菌細胞壁成分やリポ多糖などの病原体関連分子パターンは、受容体を介して自然免疫応答を強力に活性化します【文献3】。この活性化により、炎症性サイトカインとケモカインが大量に産生され、炎症細胞の浸潤が促進されます【文献3】【文献4】。
好中球浸潤と膿疱形成の機序
赤ニキビにおける好中球浸潤は、炎症の初期段階において最も顕著な組織学的所見です。好中球は血液中を循環する顆粒球の一種であり、細菌感染や組織損傷に対する急性炎症反応において中心的な役割を果たします。毛包周囲組織で炎症性メディエーターが産生されると、これらのメディエーターが血管内皮細胞に作用し、細胞接着分子の発現を誘導します【文献3】【文献4】。血液中を流れる好中球は、内皮細胞表面に発現した接着分子と結合し、血管壁に接着します。その後、好中球は血管内皮細胞間を通過して血管外へ遊走し、ケモカインの濃度勾配に従って炎症部位へ移動します【文献3】【文献4】。この過程は走化性と呼ばれ、好中球が炎症部位へ効率的に集積する機序です【文献4】。毛包周囲組織に到達した好中球は、細菌を貪食して殺菌するとともに、活性酸素種や蛋白分解酵素を放出して組織を分解します【文献4】。
- 炎症性メディエーターが血管内皮細胞に作用し、接着分子の発現を誘導します。
- 好中球は接着分子を介して血管壁に接着します。
- 好中球は血管内皮細胞間を通過して血管外へ遊走します。
- ケモカインの濃度勾配に従って炎症部位へ移動する走化性が生じます。
- 毛包周囲組織に到達した好中球は細菌を貪食し、活性酸素種や蛋白分解酵素を放出します。
好中球の大量浸潤は膿疱形成の基盤となります。好中球が細菌を貪食すると、細胞内で酸化的バーストが生じ、活性酸素種により細菌が殺菌されます。しかし、この過程で好中球自身も損傷を受け、最終的には死滅します【文献4】。死滅した好中球の細胞質成分と核物質が組織内に蓄積すると、膿として視認されます。膿は主に死滅した好中球、細菌の残骸、組織液から構成され、黄白色を呈します【文献5】。赤ニキビの炎症が進行すると、毛包内腔および毛包周囲組織に膿が蓄積し、膿疱が形成されます【文献5】。膿疱は黄色の膿を含む水疱として視認され、触診では波動を触知します。膿疱が形成された段階では、炎症はすでに中等度以上に進行しており、毛包壁の破綻も広範囲に及んでいます【文献5】。膿疱を放置すると、炎症がさらに深部へ進展し、真皮深層や皮下組織にまで及ぶ結節が形成される可能性があります【文献5】。したがって、好中球浸潤と膿疱形成は、赤ニキビの病態進行における重要な段階として認識されます【文献4】【文献5】。
リンパ球浸潤と慢性炎症への移行
赤ニキビの炎症が遷延すると、好中球に加えてリンパ球が浸潤し、慢性炎症へと移行します。リンパ球は適応免疫応答を担う細胞であり、補助型細胞、細胞傷害性細胞、制御性細胞などの亜集団から構成されます。赤ニキビでは、特に補助型細胞が重要な役割を果たします【文献4】。補助型細胞は抗原提示を受けると活性化され、炎症性サイトカインを産生します。これらのサイトカインは、好中球やマクロファージの機能を増強し、炎症反応を増幅します【文献4】。さらに、補助型細胞は細胞の分化と機能を調節し、液性免疫応答を促進します【文献4】。赤ニキビの慢性化には、補助型細胞と制御性細胞のバランス異常が関与していると考えられています【文献4】。補助型細胞が過剰に活性化され、制御性細胞による抑制が不十分であると、炎症反応が持続し、組織損傷が進行します【文献4】。
- 補助型細胞が活性化され炎症性サイトカインを産生します。
- 好中球とマクロファージの機能が増強されます。
- 補助型細胞と制御性細胞のバランス異常が生じます。
- 組織構築が乱れ線維芽細胞が増殖します。
- コラーゲン線維が増生し線維化が進行します。
リンパ球浸潤は組織学的に毛包周囲および真皮浅層に認められます。急性期の赤ニキビでは好中球が優勢ですが、炎症が数週間持続すると、リンパ球の割合が増加します【文献4】。慢性化した赤ニキビでは、毛包周囲にリンパ球を主体とする慢性炎症細胞浸潤が認められ、組織構築が乱れています【文献4】。さらに、線維芽細胞が増殖してコラーゲン線維が増生し、線維化が進行します【文献5】。この線維化が瘢痕形成の基盤となります【文献5】。したがって、リンパ球浸潤と慢性炎症への移行は、赤ニキビが後遺症を残す機序として重要です【文献4】【文献5】。早期に炎症を抑制し、慢性化を防ぐことが、瘢痕形成を予防するうえで重要となります【文献5】。
血管拡張と血管透過性亢進による紅斑と浮腫の形成
赤ニキビの最も特徴的な臨床所見である紅斑は、炎症に伴う血管拡張の結果として生じます。炎症性メディエーターが血管平滑筋に作用すると、平滑筋が弛緩して血管が拡張し、毛包周囲組織への血流が増加します【文献3】。血管拡張を引き起こす主要なメディエーターには、ヒスタミン、プロスタグランジン、一酸化窒素などがあります【文献3】。ヒスタミンは肥満細胞から放出され、血管平滑筋上の受容体に結合して血管拡張を引き起こします。プロスタグランジンは炎症部位の細胞で合成され、血管平滑筋を直接弛緩させます【文献3】。一酸化窒素は血管内皮細胞で産生され、強力な血管拡張作用を持ちます【文献3】。これらのメディエーターにより、毛包周囲の毛細血管が拡張し、血流が増加します。増加した血流により、赤血球が組織内に多く供給され、皮膚表面から赤色として視認されます【文献3】。これが赤ニキビの紅斑の本質です【文献3】。
- ヒスタミンは血管平滑筋受容体に結合して血管拡張を引き起こします。
- プロスタグランジンは血管平滑筋を直接弛緩させます。
- 一酸化窒素は強力な血管拡張作用を持ちます。
- ブラジキニンは内皮細胞間結合を緩和します。
- 血管内皮増殖因子は透過性を直接増加させます。
血管透過性の亢進は、赤ニキビの腫脹形成に直接寄与します。炎症性メディエーターが血管内皮細胞に作用すると、内皮細胞間の結合が緩み、血管壁の透過性が増加します【文献3】【文献4】。この透過性亢進により、血漿成分が血管外へ漏出し、組織間隙に蓄積します【文献3】。蓄積した血漿成分は組織浮腫を形成し、赤ニキビの隆起性病変として触知されます【文献3】。血管透過性を亢進させる主要なメディエーターには、ヒスタミン、ブラジキニン、血管内皮増殖因子などがあります【文献3】。これらのメディエーターは、内皮細胞間の密着結合を構成する蛋白質を修飾し、細胞間隙を拡大させます【文献3】。さらに、血管内皮増殖因子は内皮細胞の透過性を直接増加させる作用を持ちます【文献3】。このような血管透過性亢進により、赤ニキビでは紅斑に加えて明瞭な腫脹が観察されます【文献3】【文献4】。
赤ニキビの好発部位と臨床的分布パターン
赤ニキビは皮脂分泌が旺盛な部位に特異的に発生します。顔面では特に額、頬、顎、鼻などの部位に好発します。これらの部位は皮脂腺が大型で密度が高いという解剖学的特徴があります【文献5】。皮脂腺の大きさと活性度は、男性ホルモン受容体の密度と還元酵素の活性に依存します。顔面の皮脂腺が豊富な領域では、これらの因子が高度に発現しており、皮脂分泌が亢進しています【文献2】。皮脂の過剰分泌は毛包内への皮脂貯留を促進し、面皰形成の素地を作ります。さらに、皮脂は細菌の増殖基質となるため、皮脂分泌が旺盛な部位では細菌増殖が促進されます【文献2】【文献3】。このため、皮脂腺が豊富な顔面の特定部位に赤ニキビが好発します【文献5】。
体幹部では特に上背部と胸部に赤ニキビが好発します。ざ瘡は患者の顔面、頸部、胸部、上背部、上腕部に発生し、これらは大型でホルモン応答性の皮脂腺が豊富な部位です【文献5】。上背部と胸部の皮脂腺も顔面と同様に、男性ホルモンの影響を強く受けます【文献2】。思春期以降、男性ホルモンの分泌が増加すると、これらの部位の皮脂腺が肥大し、皮脂分泌が亢進します【文献2】。さらに、上背部は衣服による摩擦や圧迫を受けやすく、この機械的刺激が角化異常を促進し、面皰形成を助長します。また、背部は自己観察が困難な部位であり、赤ニキビの発生に気づきにくく、放置されやすいという特徴があります【文献5】。このため、背部の赤ニキビは病態が進展しやすく、結節や嚢腫へと進行するリスクが高くなります【文献5】。
顔面における赤ニキビの分布特性
顔面における赤ニキビの分布は、年齢と性別により異なるパターンを示します。思春期では、額を中心とする上顔面に赤ニキビが多発します。これは、思春期における男性ホルモンの分泌増加が額の皮脂腺を強く刺激するためです【文献2】。額は前髪に覆われることが多く、機械的刺激と閉塞により面皰形成が促進されます。さらに、額は汗の分泌も旺盛であり、汗と皮脂が混合することで毛包閉塞がさらに助長されます。このため、思春期の赤ニキビは額に集中する傾向があります【文献5】。一方、成人では、下顔面、特に顎やフェイスラインに赤ニキビが多発します【文献5】。成人女性では、月経周期に関連したホルモン変動により、顎周囲の皮脂分泌が周期的に亢進し、赤ニキビが発生します【文献5】。
- 思春期では額を中心とする上顔面に多発します。
- 成人では顎やフェイスラインなど下顔面に多発します。
- 成人女性では月経周期に関連した周期的悪化がみられます。
- 頬は全年齢で赤ニキビが発生しやすい部位です。
- 鼻は皮脂腺が最も密な部位ですが炎症性病変は比較的少ないです。
頬は全年齢において赤ニキビが発生しやすい部位です。頬の皮脂腺は密度が高く、皮脂分泌が旺盛です【文献5】。さらに、頬は外部刺激に曝露されやすい部位であり、紫外線、大気汚染物質、化粧品などの刺激により炎症が増悪します。特に、化粧品に含まれる油分は毛包を閉塞し、面皰形成を促進します。また、頬は手で触れる機会が多く、この機械的刺激と細菌の伝播により赤ニキビが悪化します【文献5】。鼻は顔面で最も皮脂腺が密な部位ですが、炎症性病変である赤ニキビは比較的少なく、開放面皰である黒ニキビが多発します【文献2】。これは、鼻の毛孔が大きく開大しており、皮脂が比較的自由に排出されるため、毛包内圧の上昇と毛包壁破綻が生じにくいためと考えられます【文献5】。
体幹部における赤ニキビの分布特性
体幹部では、上背部が最も赤ニキビが多発する部位です。上背部の皮脂腺は顔面と同様に大型で密度が高く、思春期以降に男性ホルモンの影響により活性化されます【文献2】【文献5】。上背部は衣服により常に覆われているため、閉塞環境が形成され、毛包内に皮脂と汗が貯留しやすくなります。さらに、衣服による機械的摩擦が角化異常を促進し、面皰形成を助長します【文献5】。特に、密着性の高い衣服や通気性の悪い素材の衣服を着用すると、閉塞と摩擦が増強され、赤ニキビが悪化します。また、上背部は自己観察が困難であるため、初期の面皰段階で気づくことが難しく、炎症が進行してから初めて自覚されることが多いです【文献5】。このため、上背部の赤ニキビは重症化しやすく、結節や嚢腫へと進展するリスクが高くなります【文献5】。
- 上背部は衣服により常に覆われ閉塞環境が形成されます。
- 衣服による機械的摩擦が角化異常を促進します。
- 自己観察が困難で初期段階での気づきが遅れます。
- 重症化しやすく結節や嚢腫へ進展しやすいです。
- 瘢痕形成のリスクが高い部位です。
胸部も赤ニキビが好発する部位です。胸部の皮脂腺は上背部と同様に大型で密度が高く、ホルモン応答性が高いです【文献2】【文献5】。胸部は衣服による閉塞と摩擦を受けやすく、特に女性では下着による機械的刺激が加わります。さらに、胸部は汗の分泌が旺盛な部位であり、汗と皮脂が混合して毛包閉塞を促進します【文献5】。運動時や高温環境では、胸部の発汗がさらに増加し、赤ニキビが悪化する傾向があります。上腕部にも赤ニキビが発生しますが、顔面や体幹部と比較すると頻度は低いです【文献5】。上腕部の赤ニキビは、主に上腕外側に発生し、摩擦や圧迫などの機械的刺激が誘因となることが多いです【文献5】。このように、赤ニキビの分布は皮脂腺の密度と活性度、機械的刺激、閉塞環境などの複合的な要因により決定されます【文献2】【文献5】。
ニキビの発生段階と赤ニキビへの進行過程
赤ニキビは突然発生するのではなく、段階的な病態進行の結果として形成されます。尋常性ざ瘡の発生過程は、微小面皰の形成に始まり、閉鎖面皰、開放面皰を経て、炎症性病変である赤ニキビへと進展します【文献2】【文献5】。この進行過程は、皮脂分泌亢進、毛包漏斗部の角化異常、細菌増殖、炎症惹起という四つの病態生理学的要素が順次または並行して作用することで駆動されます【文献1】【文献2】。赤ニキビの形成を理解するためには、これらの段階を順を追って把握することが不可欠です。各段階は独立した病態ではなく、連続的な病態進行の一部として理解されます【文献2】【文献5】。さらに、すべての面皰が必ずしも赤ニキビへと進展するわけではなく、一部の面皰は非炎症性のまま自然消退します【文献5】。しかし、特定の条件下では面皰から赤ニキビへの移行が促進され、この移行過程こそが赤ニキビの病態理解において最も重要な段階となります【文献3】【文献4】【文献5】。
ざ瘡の発生は、思春期におけるホルモン変動と密接に関連しています。思春期以降、副腎および性腺から分泌される男性ホルモンが増加し、これが皮脂腺を刺激して皮脂分泌を亢進させます【文献2】。皮脂腺細胞には男性ホルモン受容体が高密度に発現しており、男性ホルモンがこの受容体に結合すると、細胞内でシグナル伝達が活性化され、皮脂腺の分化と皮脂合成が促進されます【文献2】。さらに、皮脂腺および毛包周囲組織には還元酵素が発現しており、この酵素がテストステロンをより活性の高いジヒドロテストステロンへ変換します【文献2】。ジヒドロテストステロンは男性ホルモン受容体への親和性が高く、皮脂分泌をさらに強力に刺激します【文献2】。この結果、思春期以降の皮脂分泌は顕著に増加し、毛包内への皮脂貯留が開始されます【文献2】。皮脂分泌の亢進は、ざ瘡発生の最初の病態生理学的変化であり、以後のすべての段階の基盤となります【文献1】【文献2】。
皮脂分泌の亢進と並行して、毛包漏斗部における角化異常が生じます。正常な毛包では、角化細胞は規則的に産生され、分化しながら毛包内腔へと移動し、最終的には皮脂とともに毛孔から排出されます。しかし、ざ瘡では、毛包漏斗部の角化細胞の産生速度が亢進し、さらに角化細胞間の接着性が増加して、正常な剥離が障害されます【文献1】【文献2】。この角化異常の機序には、複数の因子が関与しています。男性ホルモンは角化細胞の増殖を直接刺激し、角化細胞の産生速度を増加させます【文献2】。さらに、皮脂組成の変化、特にリノール酸含量の低下が角化異常を促進します【文献2】。リノール酸は角質細胞間脂質の構成成分であり、正常な角化細胞の剥離に必要です。皮脂中のリノール酸が減少すると、角化細胞間の接着性が増加し、角質栓が形成されます【文献2】。この角化異常により、毛包内腔に角質と皮脂が蓄積し、微小面皰が形成されます【文献1】【文献2】【文献5】。
微小面皰から閉鎖面皰への進展機序
微小面皰は、ざ瘡における最初の病変であり、臨床的には視認されない微細な構造です。微小面皰は、毛包漏斗部における角質栓の形成により、毛包内腔が部分的に閉塞された状態を指します【文献1】【文献2】。組織学的には、毛包漏斗部に角化細胞と皮脂が混合した小さな栓が認められます。この段階では、毛包の拡張は軽度であり、炎症所見も認められません【文献2】。微小面皰の形成は、角化異常と皮脂分泌亢進の直接的な結果です。毛包漏斗部で産生された角化細胞は、正常であれば規則的に剥離して毛孔から排出されますが、角化異常により剥離が障害され、毛包内腔に蓄積します【文献1】【文献2】。同時に、亢進した皮脂分泌により、大量の皮脂が毛包内に分泌されます。この皮脂と角質が混合して、毛包内腔に栓を形成します【文献1】【文献2】。
微小面皰が進展すると、閉鎖面皰が形成されます。閉鎖面皰は、毛孔が角質栓により完全に閉塞され、毛包内腔に皮脂と角質が大量に貯留した状態です【文献2】。臨床的には、直径1〜3mm程度の白色または肌色の小丘疹として視認されます。これが白ニキビと呼ばれる病態です【文献2】。閉鎖面皰の形成過程では、継続的な皮脂分泌と角質蓄積により、毛包内圧が徐々に上昇します【文献5】。毛包内圧の上昇は、毛包壁を外側へ押し広げ、毛包の拡張を引き起こします【文献5】。組織学的には、毛包漏斗部が嚢状に拡張し、その内腔は緻密な角質栓と皮脂で充満しています【文献2】。毛孔は角質栓により完全に閉塞されており、外部との交通は遮断されています【文献2】。この閉鎖状態により、毛包内は低酸素環境となり、嫌気性細菌の増殖に適した条件が形成されます【文献2】【文献3】。
閉鎖面皰における毛包内環境の変化
閉鎖面皰では、毛孔の閉塞により毛包内環境が劇的に変化します。最も重要な変化は、酸素濃度の低下です。正常な毛包では、毛孔を介して外部から酸素が供給されますが、閉鎖面皰では毛孔が完全に閉塞されているため、外部からの酸素供給が遮断されます【文献2】【文献3】。毛包内の細胞と細菌は酸素を消費するため、閉鎖状態が持続すると毛包内の酸素濃度が徐々に低下します【文献3】。この低酸素環境は、嫌気性細菌であるアクネ菌の増殖に最適な条件を提供します【文献2】【文献3】。アクネ菌は皮膚常在菌であり、正常な皮膚にも存在しますが、閉鎖面皰の低酸素環境では急速に増殖します【文献2】【文献3】。アクネ菌は毛包内に貯留した皮脂を栄養源として利用し、その数は正常毛包と比較して数十倍から数百倍に増加します【文献3】。
- 毛孔が角質栓により完全に閉塞され外部との交通が遮断されます。
- 外部からの酸素供給が遮断され毛包内の酸素濃度が低下します。
- 低酸素環境が形成されアクネ菌の増殖に最適な条件となります。
- アクネ菌が皮脂を栄養源として急速に増殖します。
- アクネ菌の数が正常毛包と比較して数十倍から数百倍に増加します。
閉鎖面皰における水素イオン濃度の変化も重要です。正常な皮膚表面は弱酸性であり、これが常在菌叢の維持と病原菌の侵入防御に寄与しています。しかし、閉鎖面皰では、アクネ菌が皮脂中のトリグリセリドを分解して遊離脂肪酸を産生するため、毛包内の水素イオン濃度が低下します【文献3】。遊離脂肪酸は弱酸性を示すため、その蓄積により毛包内環境がさらに酸性化します。この酸性環境はアクネ菌の増殖をさらに促進する一方、他の細菌の増殖を抑制します【文献3】。さらに、閉鎖面皰では毛包内圧が上昇し、毛包壁に対する機械的ストレスが増大します【文献5】。持続的な内圧上昇は、毛包上皮を菲薄化させ、毛包壁の脆弱性を増加させます【文献5】。この脆弱化した毛包壁は、後述する炎症への移行において、破綻しやすくなります【文献4】【文献5】。
閉鎖面皰から開放面皰への移行様式
閉鎖面皰は、毛包内圧の上昇により、毛孔を閉塞していた角質栓が破綻すると、開放面皰へと移行します。毛包内圧が一定の閾値を超えると、角質栓を構成する角化細胞間の接着が破綻し、毛孔が開大します【文献2】。開大した毛孔から、毛包内に貯留していた皮脂と角質の一部が皮膚表面へ排出されます。しかし、毛包内腔には依然として大量の角質栓が残存しており、この残存した角質栓が空気に曝露されることで酸化反応が進行し、黒色を呈するようになります【文献2】。これが開放面皰、すなわち黒ニキビです【文献2】。開放面皰では、毛孔が開大しているため、毛包内への酸素供給が再開されます。しかし、角質栓が毛包内腔を充満しているため、酸素は表層部にのみ到達し、深部は依然として低酸素状態に保たれます【文献2】【文献3】。
- 毛包内圧の上昇により角質栓が破綻し毛孔が開大します。
- 皮脂と角質の一部が皮膚表面へ排出されます。
- 残存した角質栓が空気に曝露され酸化反応が進行します。
- 酸化により黒色を呈し開放面皰が形成されます。
- 毛包内への酸素供給が再開されますが深部は低酸素状態を維持します。
開放面皰における酸素環境の変化は、細菌叢にも影響を及ぼします。表層部では酸素濃度が上昇するため、好気性細菌の増殖が促進される可能性があります。一方、深部では依然として低酸素状態が維持されるため、アクネ菌の増殖は継続します【文献2】【文献3】。このような酸素勾配の存在により、開放面皰では閉鎖面皰とは異なる細菌叢が形成されます【文献3】。開放面皰は必ずしも炎症性病変へと進展するわけではなく、多くの場合は非炎症性のまま持続します【文献5】。しかし、毛包内でアクネ菌が過剰に増殖し、毛包壁が破綻すると、閉鎖面皰と同様に炎症性病変へと移行します【文献3】【文献4】【文献5】。したがって、閉鎖面皰と開放面皰は、いずれも赤ニキビへと進展する可能性を内包しています【文献5】。
面皰から赤ニキビへの移行における炎症惹起機序
面皰から赤ニキビへの移行は、炎症反応の惹起により特徴づけられます。この移行過程における最も重要な事象は、毛包壁の破綻と毛包内容物の真皮内漏出です【文献4】【文献5】。面皰では、毛包内圧の上昇、アクネ菌が産生する酵素による毛包上皮の分解、遊離脂肪酸による毛包壁の刺激などにより、毛包壁の脆弱性が増加しています【文献4】【文献5】。これらの要因により、毛包壁が部分的または完全に破綻すると、毛包内容物が真皮内へ漏出します【文献4】【文献5】。漏出した内容物には、アクネ菌、皮脂分解産物、角質、そしてアクネ菌由来の病原体関連分子パターンが含まれています【文献3】【文献4】。これらの物質は、真皮内で強力な炎症刺激として作用します【文献3】【文献4】。特に、アクネ菌の細胞壁成分は受容体を介して自然免疫応答を活性化し、炎症性サイトカインとケモカインの産生を誘導します【文献3】【文献4】。
アクネ菌の細胞壁にはペプチドグリカンとリポテイコ酸が含まれており、これらは病原体関連分子パターンとして認識されます【文献3】。毛包上皮細胞および真皮内の樹状細胞やマクロファージの表面には、これらの病原体関連分子パターンを認識する受容体が発現しています【文献3】。アクネ菌の細胞壁成分がこれらの受容体に結合すると、細胞内でシグナル伝達カスケードが活性化され、転写因子が核内へ移行します【文献3】。この転写因子は炎症性サイトカインの遺伝子発現を誘導し、大量のサイトカインが産生されます【文献3】。産生される主要なサイトカインには、腫瘍壊死因子、インターロイキン1、インターロイキン6、インターロイキン8などがあります【文献3】【文献4】。これらのサイトカインは、血管内皮細胞に作用して血管拡張と血管透過性亢進を引き起こし、さらに好中球やマクロファージなどの炎症細胞を炎症部位へ動員します【文献3】【文献4】。この一連の炎症反応により、毛包周囲組織に紅斑と腫脹が生じ、赤ニキビが形成されます【文献3】【文献4】【文献5】。
アクネ菌由来因子による炎症惹起の分子機序
アクネ菌は、炎症惹起において中心的な役割を果たす複数の因子を産生します。最も重要な因子の一つは、受容体2のリガンドとなる細胞壁成分です。アクネ菌の細胞壁にはペプチドグリカンとリポテイコ酸が含まれており、これらは受容体2により認識されます【文献3】。受容体2は、毛包上皮細胞、角化細胞、樹状細胞、マクロファージなどの表面に発現しており、病原体関連分子パターンを認識して自然免疫応答を開始します【文献3】。アクネ菌の細胞壁成分が受容体2に結合すると、受容体に会合しているアダプター蛋白質が活性化され、シグナル伝達カスケードが開始されます【文献3】。このカスケードにより、最終的に転写因子が活性化され、核内へ移行して炎症性サイトカインの遺伝子発現を誘導します【文献3】。この受容体2を介したシグナル伝達は、赤ニキビにおける炎症惹起の主要な経路の一つです【文献3】。
- アクネ菌の細胞壁成分が受容体2に結合します。
- 受容体に会合するアダプター蛋白質が活性化されます。
- シグナル伝達カスケードが開始されます。
- 転写因子が活性化され核内へ移行します。
- 炎症性サイトカインの遺伝子発現が誘導されます。
アクネ菌はリパーゼを産生し、このリパーゼが皮脂中のトリグリセリドを分解して遊離脂肪酸を生成します【文献3】。遊離脂肪酸は、毛包壁に対して直接的な刺激作用を持ち、炎症を惹起します【文献3】。特に、不飽和脂肪酸は炎症惹起能が高く、毛包上皮細胞に作用して炎症性メディエーターの産生を促進します【文献3】。さらに、遊離脂肪酸は血管透過性を亢進させ、炎症細胞の浸潤を促進します【文献3】。アクネ菌はプロテアーゼも産生し、このプロテアーゼが毛包壁を構成する蛋白質を分解して、毛包壁の破綻を促進します【文献4】。また、アクネ菌が産生するポルフィリンは、光感受性物質であり、紫外線に曝露されると活性酸素種を生成します【文献3】。この活性酸素種は周囲組織を酸化的に損傷し、炎症を増悪させます【文献3】。このように、アクネ菌は複数の機序を介して炎症を惹起し、面皰から赤ニキビへの移行を促進します【文献3】【文献4】。
毛包壁破綻後の炎症カスケードの展開
毛包壁が破綻して毛包内容物が真皮内へ漏出すると、即座に炎症反応が開始されます。漏出した内容物に含まれる病原体関連分子パターンは、真皮内の樹状細胞やマクロファージにより認識され、これらの細胞が活性化されます【文献3】【文献4】。活性化された樹状細胞とマクロファージは、大量の炎症性サイトカインを産生します【文献3】【文献4】。最初に産生されるサイトカインは、腫瘍壊死因子とインターロイキン1です【文献3】。これらのサイトカインは、血管内皮細胞に作用して接着分子の発現を誘導し、好中球の血管壁への接着を促進します【文献3】【文献4】。同時に、ケモカインであるインターロイキン8が産生され、これが好中球の走化性を誘導します【文献3】【文献4】。この結果、好中球が血管外へ遊走し、毛包周囲組織へ大量に浸潤します【文献4】。
- 樹状細胞とマクロファージが病原体関連分子パターンを認識し活性化されます。
- 腫瘍壊死因子とインターロイキン1が産生されます。
- 血管内皮細胞に接着分子が発現され好中球の接着が促進されます。
- インターロイキン8が産生され好中球の走化性が誘導されます。
- 好中球が血管外へ遊走し毛包周囲組織へ大量に浸潤します。
浸潤した好中球は、アクネ菌を貪食して殺菌しますが、同時に活性酸素種と蛋白分解酵素を放出し、周囲の正常組織も損傷します【文献4】。この組織損傷がさらなる炎症性メディエーターの放出を誘導し、炎症反応が増幅されます【文献4】。このような正のフィードバック機構により、一度開始された炎症反応は自己増幅的に進行します【文献4】。炎症反応の進行に伴い、血管拡張と血管透過性亢進により、毛包周囲組織に紅斑と浮腫が形成されます【文献3】。これが赤ニキビの臨床的特徴である紅色丘疹として視認されます【文献3】【文献5】。したがって、面皰から赤ニキビへの移行は、毛包壁破綻を契機とした炎症カスケードの展開により特徴づけられます【文献3】【文献4】【文献5】。
赤ニキビの病態生理学的メカニズム
赤ニキビの病態生理学的メカニズムは、皮脂分泌亢進、毛包角化異常、細菌増殖、炎症反応という四つの主要な要素が複合的に作用することで構成されます【文献1】【文献2】。これらの要素は独立して作用するのではなく、相互に影響を及ぼしながら病態を形成します【文献2】。皮脂分泌亢進は男性ホルモンの刺激により生じ、毛包内への皮脂貯留を促進します【文献2】。毛包角化異常は角化細胞の過剰増殖と剥離障害により生じ、毛包閉塞を引き起こします【文献1】【文献2】。細菌増殖は閉塞した毛包内の低酸素環境で促進され、炎症惹起の基盤となります【文献2】【文献3】。炎症反応は細菌由来の病原体関連分子パターンと皮脂分解産物により惹起され、免疫系が活性化されることで赤ニキビの特徴的な紅斑と腫脹が形成されます【文献3】【文献4】。これらの要素を個別に理解するとともに、それらの相互作用を把握することが、赤ニキビの病態生理を包括的に理解するうえで不可欠です【文献1】【文献2】【文献5】。
赤ニキビの病態生理を理解するうえで重要なのは、炎症が単なる細菌感染の結果ではなく、複雑な免疫学的プロセスの帰結であるという認識です。従来、赤ニキビはアクネ菌感染による単純な感染症と考えられていましたが、現在では、アクネ菌は皮膚常在菌であり、感染症を引き起こす病原菌ではないことが明らかになっています【文献2】【文献3】。赤ニキビにおける炎症は、アクネ菌そのものではなく、アクネ菌由来の病原体関連分子パターンに対する宿主の免疫応答として理解されます【文献3】【文献4】。さらに、炎症が顕在化する以前から、面皰周囲の皮膚には潜在的な炎症が存在することが明らかになっています【文献4】。この潜在的炎症は、臨床的には視認されませんが、組織学的には軽度の炎症細胞浸潤として認められます【文献4】。したがって、赤ニキビの炎症は突然発生するのではなく、面皰段階から徐々に進行する炎症プロセスの顕在化として理解されます【文献4】【文献5】。
赤ニキビの病態生理学的メカニズムを理解する際には、時間軸に沿った病態の進行を把握することが重要です。ざ瘡の発生は思春期における男性ホルモンの分泌増加により開始され、これが皮脂分泌を亢進させます【文献2】。皮脂分泌の亢進は数週間から数か月かけて徐々に進行し、毛包内への皮脂貯留が蓄積します【文献2】。並行して、毛包角化異常が進行し、角質栓が形成されます【文献1】【文献2】。角質栓による毛包閉塞が確立すると、毛包内は低酸素環境となり、アクネ菌の増殖が開始されます【文献2】【文献3】。アクネ菌の増殖は数日から数週間で急速に進行し、毛包内のアクネ菌数は正常の数十倍から数百倍に達します【文献3】。この段階で、アクネ菌由来の炎症刺激が蓄積し、毛包壁の脆弱性が増加します【文献4】。最終的に毛包壁が破綻すると、炎症反応が急速に進行し、数時間から数日以内に赤ニキビが形成されます【文献4】【文献5】。このように、赤ニキビの形成は数週間から数か月にわたる病態進行の帰結として理解されます【文献2】【文献5】。
皮脂分泌亢進の内分泌学的機序
皮脂分泌亢進は、赤ニキビの病態生理における最も基本的な要素です。皮脂は皮脂腺細胞で合成され、全分泌様式により毛包内腔へ分泌されます。全分泌様式とは、細胞全体が崩壊して細胞内容物が分泌される機序であり、皮脂腺細胞は成熟するにつれて細胞内に脂質を蓄積し、最終的に細胞膜が破綻して皮脂として放出されます【文献2】。この皮脂分泌過程は、男性ホルモンにより強力に制御されています【文献2】。思春期以降、副腎および性腺から分泌される男性ホルモン、主にテストステロンとデヒドロエピアンドロステロンが増加します【文献2】。これらの男性ホルモンは血液を介して皮脂腺に到達し、皮脂腺細胞に作用します【文献2】。皮脂腺細胞には男性ホルモン受容体が高密度に発現しており、男性ホルモンがこの受容体に結合すると、細胞内でシグナル伝達が活性化されます【文献2】。
男性ホルモンのシグナル伝達は、皮脂腺細胞の増殖と分化を促進します。男性ホルモン受容体は、男性ホルモンと結合すると核内へ移行し、特定の遺伝子のプロモーター領域に結合して転写を活性化します【文献2】。活性化される遺伝子には、細胞増殖に関与する遺伝子と、脂質合成に関与する酵素の遺伝子が含まれます【文献2】。細胞増殖の促進により、皮脂腺の大きさが増大し、皮脂産生能力が向上します【文献2】。脂質合成酵素の発現増加により、個々の細胞内での脂質合成が亢進します【文献2】。さらに、皮脂腺および毛包周囲組織には還元酵素が発現しており、この酵素がテストステロンをより活性の高いジヒドロテストステロンへ変換します【文献2】。ジヒドロテストステロンは男性ホルモン受容体への親和性が約10倍高く、皮脂分泌をさらに強力に刺激します【文献2】。この還元酵素の活性は個体差が大きく、酵素活性が高い個体ではジヒドロテストステロンの産生が増加し、皮脂分泌がより亢進します【文献2】。
皮脂組成の変化と面皰形成への寄与
赤ニキビの病態では、皮脂分泌量の増加だけでなく、皮脂組成の変化も重要な役割を果たします。正常な皮脂は、トリグリセリド、ワックスエステル、スクアレン、遊離脂肪酸、コレステロールなどから構成されます【文献2】。しかし、ざ瘡患者の皮脂では、特定の脂肪酸組成に変化が認められます【文献2】。最も重要な変化は、リノール酸含量の低下です【文献2】。リノール酸は必須脂肪酸であり、食事から摂取されて体内で利用されます。正常な皮脂ではリノール酸が一定量含まれていますが、ざ瘡患者では皮脂分泌が亢進することで、皮脂中のリノール酸が希釈され、相対的な含量が低下します【文献2】。リノール酸は角質細胞間脂質の重要な構成成分であり、角化細胞の正常な分化と剥離に必要です【文献2】。皮脂中のリノール酸が低下すると、毛包漏斗部の角化細胞におけるリノール酸の供給が不足し、角化異常が生じます【文献2】。
- ざ瘡患者の皮脂ではリノール酸含量が低下します。
- リノール酸は角質細胞間脂質の重要な構成成分です。
- リノール酸の低下により角化細胞の分化と剥離に異常が生じます。
- 角化異常により角質栓が形成され毛包が閉塞します。
- 毛包閉塞が面皰形成の直接的な原因となります。
皮脂中のスクアレン含量の増加も、ざ瘡の病態に寄与します。スクアレンは不飽和炭化水素であり、酸化を受けやすい性質を持ちます【文献2】。ざ瘡患者の皮脂ではスクアレン含量が増加しており、このスクアレンが酸化されるとスクアレン過酸化物が生成されます【文献2】。スクアレン過酸化物は面皰形成を促進する作用を持ち、実験的にスクアレン過酸化物を皮膚に塗布すると面皰が形成されることが示されています【文献1】。さらに、スクアレン過酸化物は炎症惹起能を持ち、毛包周囲組織に軽度の炎症を誘導します【文献1】。この潜在的炎症が、後の顕在的炎症への移行を促進する可能性があります【文献4】。したがって、皮脂組成の変化は、面皰形成と炎症惹起の両方に寄与する重要な病態要素です【文献1】【文献2】【文献4】。
皮脂分泌亢進に対するホルモン以外の調節因子
皮脂分泌は男性ホルモン以外にも、複数の因子により調節されます。インスリン様成長因子は、皮脂腺細胞の増殖と脂質合成を促進する作用を持ちます【文献2】。インスリン様成長因子の血中濃度は、食事による血糖上昇に応答して増加します。特に、高血糖指数食を摂取すると、インスリン分泌が増加し、これがインスリン様成長因子の産生を刺激します【文献2】。増加したインスリン様成長因子は皮脂腺に作用し、皮脂分泌を亢進させます【文献2】。このため、高血糖指数食の頻繁な摂取は、ざ瘡を悪化させる可能性があります【文献2】。また、神経ペプチドも皮脂分泌の調節に関与します【文献1】。ストレス時に放出される物質は、皮脂腺細胞に作用して皮脂分泌を増加させます【文献1】。さらに、物質は皮脂腺細胞の増殖と分化を促進し、皮脂腺の大きさを増大させます【文献1】。このため、心理的ストレスはざ瘡を悪化させる要因となります【文献1】【文献5】。
- インスリン様成長因子は皮脂腺細胞の増殖と脂質合成を促進します。
- 高血糖指数食の摂取によりインスリン様成長因子の産生が増加します。
- 神経ペプチドがストレス時に放出され皮脂分泌を増加させます。
- 物質が皮脂腺細胞の増殖と分化を促進します。
- 心理的ストレスがざ瘡を悪化させる要因となります。
皮脂腺細胞自身も、自己分泌的に皮脂分泌を調節します。皮脂腺細胞は炎症性メディエーターを産生する能力を持ち、これらのメディエーターが皮脂分泌に影響を及ぼします【文献4】。特に、炎症性サイトカインは皮脂腺細胞の脂質合成を調節することが示されています【文献4】。さらに、皮脂腺細胞は受容体を発現しており、細菌由来の病原体関連分子パターンを直接認識して炎症性メディエーターを産生します【文献3】【文献4】。この皮脂腺細胞の免疫学的機能は、赤ニキビにおける炎症惹起において重要な役割を果たします【文献3】【文献4】。したがって、皮脂腺は単なる脂質分泌器官ではなく、免疫応答に積極的に関与する器官として理解されます【文献3】【文献4】。
毛包角化異常の細胞生物学的機序
毛包角化異常は、赤ニキビの病態生理において皮脂分泌亢進と並ぶ重要な要素です。正常な毛包では、角化細胞は基底層で産生され、分化しながら上方へ移動し、最終的には角質細胞として剥離します。この角化細胞の産生、分化、剥離のバランスが正常に保たれることで、毛包内腔の開通性が維持されます【文献1】【文献2】。しかし、ざ瘡では、このバランスが破綻し、角化細胞の過剰増殖と剥離障害が生じます【文献1】【文献2】。角化細胞の過剰増殖は、男性ホルモンの直接的な刺激により生じます【文献2】。男性ホルモンは毛包漏斗部の角化細胞に作用し、細胞増殖を促進します【文献2】。さらに、インスリン様成長因子も角化細胞の増殖を刺激します【文献2】。これらのホルモンの作用により、角化細胞の産生速度が亢進し、毛包内腔への角質の蓄積が増加します【文献2】。
角化細胞の剥離障害は、細胞間接着の異常により生じます。正常な角化過程では、角化細胞が分化するにつれて細胞間の接着が徐々に弱まり、最終的には剥離します。しかし、ざ瘡では、角化細胞間の接着が異常に強化され、正常な剥離が障害されます【文献1】【文献2】。この接着強化の機序には、デスモソームの過剰形成が関与します【文献1】。デスモソームは角化細胞間の主要な接着構造であり、細胞膜を貫通する接着分子と細胞内のトノフィラメントから構成されます。ざ瘡の毛包では、デスモソームの数と大きさが増加しており、これが角化細胞の強固な接着をもたらします【文献1】。さらに、角質細胞間脂質の組成異常も剥離障害に寄与します【文献2】。前述のように、皮脂中のリノール酸含量の低下により、毛包漏斗部の角化細胞におけるリノール酸の供給が不足します【文献2】。リノール酸はセラミドの構成成分であり、正常な角質細胞間脂質の形成に必要です【文献2】。リノール酸が不足すると、角質細胞間脂質の組成が変化し、角化細胞間の凝集性が亢進します【文献2】。
角質栓形成過程における細胞動態
角質栓の形成は、角化細胞の過剰増殖と剥離障害が複合的に作用することで進行します。毛包漏斗部で産生された角化細胞は、通常であれば規則的に分化して毛包内腔へ移動し、皮脂とともに毛孔から排出されます。しかし、ざ瘡では、角化細胞の産生速度が亢進しているため、毛包内腔へ送り込まれる角化細胞の数が増加します【文献1】【文献2】。同時に、剥離障害により、毛包内腔に到達した角化細胞が正常に剥離せず、毛包内に蓄積します【文献1】【文献2】。蓄積した角化細胞は、互いに強固に接着して角質栓を形成します【文献1】。角質栓の形成初期には、角化細胞と皮脂が混合した疎な構造が形成されますが、時間の経過とともに、継続的な角化細胞の蓄積により角質栓は緻密化します【文献1】【文献2】。緻密化した角質栓は、毛包内腔を物理的に閉塞し、皮脂の排出を妨げます【文献1】【文献2】。
- 角化細胞の産生速度が亢進し毛包内腔への角化細胞供給が増加します。
- 剥離障害により毛包内腔に到達した角化細胞が蓄積します。
- 蓄積した角化細胞が互いに強固に接着して角質栓を形成します。
- 継続的な角化細胞の蓄積により角質栓が緻密化します。
- 緻密化した角質栓が毛包内腔を物理的に閉塞し皮脂排出を妨げます。
角質栓の組成は、単なる角化細胞の集合ではなく、複雑な構造を持ちます。角質栓には、角化細胞、皮脂、細菌、そして場合によっては真菌が含まれます【文献2】。角化細胞は、その分化段階により異なる特性を持ちます。角質栓の深部には、比較的未分化な角化細胞が存在し、これらは核を保持しています。一方、表層部には完全に角化した角質細胞が存在し、これらは核を失い、角質蛋白に富んでいます【文献1】【文献2】。皮脂は角化細胞間の間隙を埋めるように分布し、角質栓全体に浸透しています【文献2】。細菌は主にアクネ菌であり、角質栓の深部、特に低酸素環境が維持される領域に高密度で存在します【文献2】【文献3】。このような複雑な組成を持つ角質栓は、単純な機械的除去では完全に排除することが困難であり、薬物療法による溶解が必要となります【文献2】【文献5】。
角化異常を促進する内因性および外因性因子
角化異常は、ホルモンによる内因性の刺激だけでなく、外因性の因子によっても促進されます。紫外線曝露は角化異常を悪化させる重要な外因性因子です。紫外線は角化細胞に直接作用し、細胞増殖を刺激するとともに、炎症性メディエーターの産生を誘導します【文献1】。さらに、紫外線は皮脂中のスクアレンを酸化し、スクアレン過酸化物を生成します【文献1】。スクアレン過酸化物は面皰形成を促進する作用を持つため、紫外線曝露は角化異常と面皰形成を二重の機序で促進します【文献1】。機械的刺激も角化異常を促進します。頻繁な洗顔や擦り洗いは、毛包漏斗部の角化細胞を刺激し、防御反応として角化細胞の増殖を亢進させます【文献5】。さらに、密着性の高い衣服や帽子による圧迫や摩擦も、角化異常を促進します【文献5】。
- 紫外線曝露は角化細胞の増殖を刺激し炎症性メディエーターを誘導します。
- 紫外線は皮脂中のスクアレンを酸化しスクアレン過酸化物を生成します。
- 頻繁な洗顔や擦り洗いが毛包漏斗部の角化細胞を刺激します。
- 密着性の高い衣服や帽子による圧迫と摩擦が角化異常を促進します。
- 化粧品に含まれる油分が毛包を閉塞し角質栓形成を助長します。
化粧品の使用も角化異常に影響を及ぼします。特に、油分を多く含む化粧品は毛包を閉塞し、角質栓の形成を助長します【文献5】。化粧品に含まれる特定の成分、特にラノリン、ミリスチン酸イソプロピル、ミリスチン酸ミリスチルなどは、面皰形成を促進することが知られています【文献5】。これらの成分は、毛包漏斗部の角化異常を促進し、角質栓の形成を加速します【文献5】。さらに、喫煙も角化異常を促進する因子です。タバコの煙に含まれる化学物質は、角化細胞に酸化ストレスを与え、角化異常を誘導します【文献2】。喫煙者では非喫煙者と比較してざ瘡の有病率が高く、また重症度も高いことが報告されています【文献2】。このように、角化異常は内因性および外因性の複数の因子により促進され、これが赤ニキビの病態形成に寄与します【文献1】【文献2】【文献5】。
アクネ菌と炎症反応の関係
アクネ菌は、赤ニキビにおける炎症惹起において中心的な役割を果たす皮膚常在菌です。アクネ菌は正式にはかつてPropionibacterium acnesと呼ばれていましたが、現在はCutibacterium acnesと分類されています【文献2】。アクネ菌はグラム陽性の嫌気性桿菌であり、皮脂に富む部位の毛包内に常在しています【文献2】【文献3】。重要な点は、アクネ菌は病原菌ではなく、健常者の皮膚にも普遍的に存在する常在菌であるということです【文献2】【文献3】。ざ瘡患者と健常者の毛包内アクネ菌数を比較した研究では、両者間に有意差がないことが示されています【文献2】。したがって、赤ニキビにおける炎症は、アクネ菌の感染によるものではなく、アクネ菌に対する宿主の免疫応答の結果として理解されます【文献2】【文献3】【文献4】。この免疫応答の性質と程度が、面皰が非炎症性のまま持続するか、赤ニキビへと進展するかを決定します【文献3】【文献4】。
アクネ菌の生物学的特性は、その炎症惹起能を理解するうえで重要です。アクネ菌は嫌気性菌であり、酸素濃度が低い環境で最もよく増殖します【文献2】【文献3】。面皰が形成されて毛包が閉塞すると、毛包内の酸素濃度が低下し、アクネ菌の増殖に最適な環境が形成されます【文献2】【文献3】。アクネ菌は皮脂を栄養源として利用し、特にトリグリセリドを分解してエネルギーを獲得します【文献3】。この分解過程でリパーゼを産生し、トリグリセリドを遊離脂肪酸とグリセロールに分解します【文献3】。生成された遊離脂肪酸は、毛包壁に対して刺激性を持ち、炎症を惹起します【文献3】。さらに、アクネ菌はプロテアーゼ、ヒアルロニダーゼ、ポルフィリンなど、複数の生物学的活性物質を産生します【文献3】【文献4】。これらの物質は、直接的または間接的に炎症反応を促進します【文献3】【文献4】。したがって、アクネ菌は単に存在するだけでなく、その代謝活動を通じて炎症惹起に積極的に寄与します【文献3】【文献4】。
アクネ菌と炎症反応の関係を理解するうえで重要なのは、アクネ菌の系統型による炎症惹起能の相違です。アクネ菌は単一の菌種ではなく、複数の系統型から構成されます【文献2】。分子生物学的解析により、アクネ菌は主要な系統型に分類されることが明らかになっています【文献2】。これらの系統型は、遺伝子配列、産生する酵素、細胞表面の抗原性などにおいて相違を示します【文献2】。重要なことに、炎症惹起能も系統型により異なることが示されています【文献2】【文献6】。特定の系統型はざ瘡病変部に優勢に存在し、高い炎症惹起能を持つことが報告されています【文献2】【文献6】。一方、他の系統型は健常皮膚に優勢に存在し、炎症惹起能が低いことが示されています【文献2】。この系統型による炎症惹起能の相違は、なぜ同じアクネ菌を持ちながら、一部の個体では赤ニキビが発生し、他の個体では発生しないのかを説明する一因となります【文献2】【文献6】。
アクネ菌によるToll様受容体活性化と自然免疫応答の開始
アクネ菌が炎症を惹起する最も重要な機序は、Toll様受容体を介した自然免疫応答の活性化です。Toll様受容体は、病原体関連分子パターンを認識して自然免疫応答を開始する受容体ファミリーです【文献3】。アクネ菌の細胞壁には、ペプチドグリカンとリポテイコ酸という二つの主要な病原体関連分子パターンが存在します【文献3】。これらの分子はToll様受容体2により認識されます【文献3】。Toll様受容体2は、毛包上皮細胞、角化細胞、皮脂腺細胞、樹状細胞、マクロファージなど、多様な細胞の表面に発現しています【文献3】【文献4】。アクネ菌の細胞壁成分がToll様受容体2に結合すると、受容体に会合しているアダプター蛋白質が活性化され、細胞内シグナル伝達カスケードが開始されます【文献3】。このカスケードは、最終的に転写因子を活性化し、この転写因子が核内へ移行して炎症性サイトカインの遺伝子発現を誘導します【文献3】。
Toll様受容体2を介したシグナル伝達により産生される主要な炎症性サイトカインには、腫瘍壊死因子、インターロイキン1、インターロイキン6、インターロイキン8があります【文献3】【文献4】。腫瘍壊死因子は強力な炎症惹起サイトカインであり、血管内皮細胞に作用して接着分子の発現を誘導し、好中球の血管壁への接着を促進します【文献3】。インターロイキン1も同様に血管内皮細胞を活性化し、さらに他の細胞からの炎症性メディエーターの産生を促進します【文献3】。インターロイキン6は急性期反応を誘導し、全身性の炎症応答を促進します【文献3】。インターロイキン8は強力なケモカインであり、好中球に対する走化性を誘導して、好中球を炎症部位へ動員します【文献3】【文献4】。これらのサイトカインが協調的に作用することで、赤ニキビにおける炎症反応が形成されます【文献3】【文献4】。したがって、Toll様受容体2を介したシグナル伝達は、アクネ菌による炎症惹起の中核的機序です【文献3】。
アクネ菌由来の病原体関連分子パターンの多様性
アクネ菌は、Toll様受容体2のリガンドとなるペプチドグリカンとリポテイコ酸以外にも、複数の病原体関連分子パターンを持ちます。これらの病原体関連分子パターンは、異なるToll様受容体により認識され、多様な免疫応答を誘導します【文献3】【文献7】。アクネ菌は細胞外小胞を放出し、この小胞には細菌由来の多様な分子が含まれています【文献7】。細胞外小胞は、直径50〜200nm程度の膜小胞であり、細菌の細胞膜に由来します【文献7】。アクネ菌由来の細胞外小胞には、リパーゼ、プロテアーゼ、細胞壁成分、核酸などが含まれています【文献7】。これらの小胞は、毛包上皮細胞や免疫細胞に取り込まれ、細胞内で病原体関連分子パターンを放出します【文献7】。特に、核酸は細胞内のToll様受容体により認識され、インターフェロンなどの抗ウイルス応答関連サイトカインの産生を誘導します【文献7】。
- アクネ菌は細胞外小胞を放出し多様な分子を含んでいます。
- 細胞外小胞には細胞壁成分、酵素、核酸が含まれます。
- 小胞は毛包上皮細胞や免疫細胞に取り込まれます。
- 細胞内で病原体関連分子パターンが放出されToll様受容体を活性化します。
- 多様なToll様受容体の活性化により複雑な免疫応答が誘導されます。
アクネ菌由来の細胞外小胞は、系統型により組成と炎症惹起能が異なることが示されています【文献7】。炎症惹起能の高い系統型由来の細胞外小胞は、より多くの炎症性メディエーターを誘導することが報告されています【文献7】。この細胞外小胞を介した炎症惹起は、従来のToll様受容体2を介した機序とは独立した経路であり、赤ニキビにおける炎症の複雑性を示しています【文献7】。さらに、アクネ菌は補体系を活性化することも示されています【文献3】。補体系は、細菌を直接殺菌するとともに、炎症反応を増幅する重要な免疫機構です【文献3】。アクネ菌の細胞壁成分は、補体の古典経路または副経路を活性化し、補体断片を生成します【文献3】。これらの補体断片は、好中球やマクロファージを活性化し、炎症部位への動員を促進します【文献3】。このように、アクネ菌は複数の病原体関連分子パターンを介して、多様な免疫応答を誘導します【文献3】【文献7】。
アクネ菌による炎症惹起における皮脂腺細胞の役割
皮脂腺細胞は、単なる脂質分泌細胞ではなく、免疫応答に積極的に関与する細胞です。皮脂腺細胞はToll様受容体2を発現しており、アクネ菌由来の病原体関連分子パターンを直接認識します【文献3】【文献4】。アクネ菌の細胞壁成分が皮脂腺細胞のToll様受容体2に結合すると、皮脂腺細胞は炎症性サイトカインとケモカインを産生します【文献3】【文献4】。特に、インターロイキン8の産生が顕著であり、これが好中球の動員を促進します【文献3】。さらに、皮脂腺細胞は抗菌ペプチドを産生する能力を持ちます【文献4】。抗菌ペプチドは、細菌の細胞膜を破壊して殺菌作用を示すとともに、免疫細胞を活性化して炎症反応を促進します【文献4】。したがって、皮脂腺細胞は、アクネ菌による炎症惹起において、受動的な標的ではなく、能動的な参加者として機能します【文献3】【文献4】。
- 皮脂腺細胞はToll様受容体2を発現し病原体関連分子パターンを認識します。
- アクネ菌の刺激により炎症性サイトカインとケモカインを産生します。
- 特にインターロイキン8の産生が顕著で好中球の動員を促進します。
- 抗菌ペプチドを産生し殺菌作用と免疫活性化作用を示します。
- 皮脂腺細胞は炎症惹起において能動的な参加者として機能します。
皮脂腺細胞による炎症性メディエーターの産生は、毛包内でのアクネ菌増殖を検知する早期警報システムとして機能します【文献4】。毛包が閉塞してアクネ菌が増殖を開始すると、アクネ菌由来の病原体関連分子パターンが皮脂腺細胞により認識され、炎症性メディエーターの産生が開始されます【文献3】【文献4】。この段階では、まだ毛包壁は破綻しておらず、臨床的には非炎症性面皰として観察されます【文献4】。しかし、組織学的には、皮脂腺および毛包周囲に軽度の炎症細胞浸潤が認められることがあります【文献4】。これが潜在的炎症と呼ばれる状態です【文献4】。潜在的炎症は、後の顕在的炎症への移行を準備する段階として理解されます【文献4】。毛包壁が破綻すると、この潜在的炎症が急速に増幅され、赤ニキビが形成されます【文献4】。したがって、皮脂腺細胞による炎症性メディエーターの産生は、面皰から赤ニキビへの移行過程において重要な役割を果たします【文献3】【文献4】。
アクネ菌産生酵素による組織損傷と炎症増幅
アクネ菌は、炎症惹起に寄与する複数の酵素を産生します。最も重要な酵素の一つはリパーゼです。アクネ菌リパーゼは、皮脂中のトリグリセリドを分解して遊離脂肪酸とグリセロールを生成します【文献3】。遊離脂肪酸、特に不飽和脂肪酸は、毛包上皮細胞に対して直接的な刺激作用を持ち、細胞損傷を引き起こします【文献3】。さらに、遊離脂肪酸は炎症性メディエーターの産生を促進し、血管透過性を亢進させます【文献3】。このため、アクネ菌リパーゼによる皮脂分解は、炎症惹起において重要な役割を果たします【文献3】。プロテアーゼもアクネ菌が産生する重要な酵素です。アクネ菌プロテアーゼは、毛包壁を構成する蛋白質、特にコラーゲンとエラスチンを分解します【文献4】。この蛋白分解により、毛包壁の構造的完全性が損なわれ、毛包壁の脆弱性が増加します【文献4】。毛包壁が脆弱化すると、毛包内圧の上昇により容易に破綻し、毛包内容物が真皮内へ漏出します【文献4】。
- アクネ菌リパーゼがトリグリセリドを分解し遊離脂肪酸を生成します。
- 遊離脂肪酸が毛包上皮細胞に刺激作用を及ぼし細胞損傷を引き起こします。
- 遊離脂肪酸が炎症性メディエーターの産生を促進します。
- アクネ菌プロテアーゼが毛包壁の蛋白質を分解します。
- 毛包壁の脆弱性が増加し破綻しやすくなります。
ヒアルロニダーゼは、アクネ菌が産生するもう一つの重要な酵素です。ヒアルロニダーゼは、真皮の主要な構成成分であるヒアルロン酸を分解します【文献4】。ヒアルロン酸は、組織の構造維持と水分保持に重要な役割を果たしています。ヒアルロニダーゼによるヒアルロン酸の分解は、真皮の構造的完全性を損ない、炎症の拡散を促進します【文献4】。さらに、分解されたヒアルロン酸断片自体が炎症性メディエーターとして機能し、免疫細胞を活性化することが示されています【文献4】。このように、アクネ菌が産生する酵素は、直接的な組織損傷を引き起こすとともに、炎症反応を増幅する多面的な作用を持ちます【文献3】【文献4】。これらの酵素による組織損傷は、面皰から赤ニキビへの移行において重要な役割を果たし、さらに炎症が進行すると瘢痕形成の基盤となります【文献4】【文献5】。
アクネ菌産生ポルフィリンによる光酸化的組織損傷
アクネ菌は、ポルフィリンという光感受性物質を産生します【文献3】。ポルフィリンは、ヘムの前駆体であり、環状の構造を持つ色素です。アクネ菌が産生する主要なポルフィリンは、コプロポルフィリンとプロトポルフィリンです【文献3】。これらのポルフィリンは、可視光線や紫外線に曝露されると励起状態となり、周囲の酸素分子を活性酸素種に変換します【文献3】。生成される活性酸素種には、一重項酸素、スーパーオキシドアニオン、過酸化水素などが含まれます【文献3】。これらの活性酸素種は、周囲の細胞膜脂質、蛋白質、核酸を酸化的に損傷します【文献3】。毛包上皮細胞や周囲組織が酸化的損傷を受けると、細胞死が誘導され、炎症反応が惹起されます【文献3】。したがって、アクネ菌産生ポルフィリンは、光曝露下で組織損傷と炎症を促進します【文献3】。
- アクネ菌はコプロポルフィリンとプロトポルフィリンを産生します。
- ポルフィリンは光曝露により励起され酸素分子を活性酸素種に変換します。
- 一重項酸素、スーパーオキシド、過酸化水素などが生成されます。
- 活性酸素種が細胞膜脂質、蛋白質、核酸を酸化的に損傷します。
- 酸化的損傷により細胞死が誘導され炎症反応が惹起されます。
ポルフィリンによる光酸化的損傷は、赤ニキビが紫外線曝露により悪化する機序の一つとして理解されます【文献3】。顔面の赤ニキビは、日光に曝露されることが多く、ポルフィリンによる光酸化反応が活発に進行します【文献3】。この光酸化反応により、炎症がさらに増悪し、組織損傷が拡大します【文献3】。ポルフィリンの光感受性は、赤ニキビの光線療法の基盤ともなっています【文献3】。特定の波長の光線を照射すると、ポルフィリンが選択的に励起され、アクネ菌を殺菌することができます【文献3】。しかし、過度の光線照射は、周囲の正常組織にも酸化的損傷を与える可能性があるため、注意が必要です【文献3】。このように、アクネ菌産生ポルフィリンは、赤ニキビの病態において二面的な役割を果たします【文献3】。
アクネ菌に対する適応免疫応答と慢性炎症
赤ニキビにおける炎症が遷延すると、自然免疫応答に加えて適応免疫応答が活性化されます。適応免疫応答は、抗原特異的な免疫応答であり、リンパ球が中心的な役割を果たします【文献4】。毛包周囲組織に浸潤した樹状細胞は、アクネ菌由来の抗原を貪食し、リンパ節へ移動してヘルパーT細胞に抗原提示を行います【文献4】。抗原提示を受けたヘルパーT細胞は活性化され、炎症性サイトカインを産生します【文献4】。特に重要なのは、Th17細胞と呼ばれるヘルパーT細胞亜集団です【文献4】。Th17細胞はインターロイキン17を産生し、このサイトカインは好中球の動員を強力に促進します【文献4】。赤ニキビ病変部では、Th17細胞の浸潤とインターロイキン17の発現が増加していることが報告されています【文献4】。Th17細胞の過剰な活性化は、炎症の慢性化と組織損傷の進行に寄与します【文献4】。
- 樹状細胞がアクネ菌由来抗原を貪食しリンパ節へ移動します。
- ヘルパーT細胞に抗原提示が行われ細胞が活性化されます。
- Th17細胞がインターロイキン17を産生し好中球動員を促進します。
- 赤ニキビ病変部ではTh17細胞とインターロイキン17の発現が増加します。
- Th17細胞の過剰活性化が炎症の慢性化と組織損傷を促進します。
適応免疫応答の活性化は、赤ニキビの慢性化において重要な役割を果たします【文献4】。一度活性化されたヘルパーT細胞は、メモリーT細胞として長期間存続し、同じ抗原に再曝露されると迅速に活性化されます【文献4】。このため、赤ニキビが治癒した後も、毛包内でアクネ菌が再増殖すると、メモリーT細胞が迅速に活性化され、炎症が再発します【文献4】。この機序が、赤ニキビの再発傾向を説明します【文献4】。さらに、制御性T細胞(Treg)と呼ばれる免疫抑制性のT細胞亜集団の機能不全も、赤ニキビの慢性化に関与します【文献4】。制御性T細胞は、過剰な免疫応答を抑制し、組織損傷を最小限に抑える役割を果たします【文献4】。赤ニキビ患者では、制御性T細胞の数または機能が低下しており、炎症応答の適切な制御が行われないことが示されています【文献4】。Th17細胞と制御性T細胞のバランス異常が、赤ニキビの慢性化と重症化に寄与します【文献4】。
赤ニキビが引き起こす皮膚組織への影響
赤ニキビは、単に皮膚表面に紅色丘疹を形成するだけでなく、毛包周囲の皮膚組織に多様な生化学的および構造的変化を引き起こします【文献4】【文献5】。これらの組織変化は、炎症反応の直接的な帰結として生じ、赤ニキビの病態を形成する重要な要素です【文献4】。赤ニキビによる組織影響は、急性期の変化と慢性期の変化に大別されます【文献4】。急性期には、血管拡張、血管透過性亢進、炎症細胞浸潤が主体であり、これらが赤ニキビの特徴的な紅斑と腫脹を形成します【文献3】【文献4】。慢性期には、持続的な炎症により組織リモデリングが進行し、コラーゲン線維の分解と再構築、線維芽細胞の増殖、血管新生などが生じます【文献4】【文献5】。これらの慢性期変化は、炎症が遷延した場合に顕著となり、組織構築の永続的な変化をもたらします【文献4】【文献5】。赤ニキビによる組織影響を理解することは、炎症がどのように皮膚組織を変化させ、最終的にどのような転帰をもたらすのかを把握するうえで不可欠です【文献4】【文献5】。
赤ニキビによる組織影響の範囲と程度は、炎症の強さと持続期間により決定されます【文献5】。軽度の赤ニキビでは、組織変化は真皮浅層に限局し、可逆的です【文献5】。この場合、炎症が沈静化すれば、組織構築は完全に回復し、永続的な変化は残りません【文献5】。しかし、炎症が強く、真皮深層にまで及ぶと、組織破壊が広範囲に生じ、不可逆的な変化をもたらします【文献5】。さらに、炎症の持続期間も組織影響の程度に大きく影響します【文献4】【文献5】。数日から数週間の急性炎症では、組織変化は比較的軽度ですが、数週間から数か月にわたる慢性炎症では、組織リモデリングが進行し、構造的変化が顕著となります【文献4】。赤ニキビによる組織影響は、炎症の動態と密接に関連しており、炎症制御が組織保護において重要となります【文献4】【文献5】。
赤ニキビによる組織影響を理解するうえで重要なのは、炎症が単に組織を破壊するだけでなく、組織修復過程をも活性化するという点です【文献4】。炎症反応には、組織破壊を促進する側面と、組織修復を促進する側面が並存します【文献4】。急性炎症の初期段階では、好中球による組織破壊が優勢ですが、炎症が進行するにつれて、マクロファージと線維芽細胞が浸潤し、組織修復が開始されます【文献4】。マクロファージは、炎症性メディエーターを産生する一方で、組織修復を促進する成長因子も産生します【文献4】。線維芽細胞は、コラーゲン線維を合成して組織の構造的完全性を回復します【文献4】。したがって、赤ニキビによる組織影響は、組織破壊と組織修復のバランスにより決定されます【文献4】。このバランスが適切に保たれれば、組織は正常に回復しますが、バランスが破綻すると、過剰な組織破壊または過剰な線維化が生じます【文献4】【文献5】。
真皮細胞外マトリックスの分解機序
赤ニキビにおける組織破壊の中核は、真皮細胞外マトリックスの分解です。真皮細胞外マトリックスは、主にコラーゲン線維、エラスチン線維、プロテオグリカンから構成され、皮膚の構造的完全性と機械的強度を維持しています【文献4】。コラーゲン線維は真皮の主要な構成成分であり、真皮乾燥重量の約70%を占めます【文献4】。赤ニキビの炎症により、これらの細胞外マトリックス成分が蛋白分解酵素により分解されます【文献4】。最も重要な蛋白分解酵素は、マトリックスメタロプロテアーゼと呼ばれる酵素ファミリーです【文献4】。マトリックスメタロプロテアーゼは、コラーゲン、エラスチン、プロテオグリカンなど、ほぼすべての細胞外マトリックス成分を分解する能力を持ちます【文献4】。赤ニキビの炎症部位では、マトリックスメタロプロテアーゼの発現と活性が著しく上昇しています【文献4】。
マトリックスメタロプロテアーゼは、炎症性サイトカインにより発現が誘導されます【文献4】。腫瘍壊死因子、インターロイキン1、インターロイキン6は、線維芽細胞、角化細胞、マクロファージに作用して、マトリックスメタロプロテアーゼの遺伝子転写を促進します【文献4】。特に、マトリックスメタロプロテアーゼ1、マトリックスメタロプロテアーゼ2、マトリックスメタロプロテアーゼ9の発現が著しく増加します【文献4】。マトリックスメタロプロテアーゼ1は、線維性コラーゲンを分解する主要な酵素です【文献4】。マトリックスメタロプロテアーゼ2とマトリックスメタロプロテアーゼ9は、基底膜を構成する4型コラーゲンを分解します【文献4】。これらの酵素により、真皮のコラーゲン線維網が破壊され、組織構築が乱れます【文献4】。さらに、好中球が放出するエラスターゼは、エラスチン線維を分解します【文献4】。エラスチン線維は皮膚の弾性を維持する重要な成分であり、その分解は皮膚の機械的特性を変化させます【文献4】。
マトリックスメタロプロテアーゼ活性の制御機構の破綻
正常な組織では、マトリックスメタロプロテアーゼの活性は、組織マトリックスメタロプロテアーゼ阻害因子により厳密に制御されています【文献4】。組織マトリックスメタロプロテアーゼ阻害因子は、マトリックスメタロプロテアーゼと結合してその活性を阻害する内因性の蛋白質です【文献4】。正常な状態では、マトリックスメタロプロテアーゼと組織マトリックスメタロプロテアーゼ阻害因子のバランスが保たれており、不必要な細胞外マトリックスの分解が防がれています【文献4】。しかし、赤ニキビの炎症では、このバランスが破綻します【文献4】。炎症性サイトカインは、マトリックスメタロプロテアーゼの発現を著しく増加させる一方、組織マトリックスメタロプロテアーゼ阻害因子の発現はほとんど増加させないか、むしろ減少させます【文献4】。この結果、マトリックスメタロプロテアーゼ活性が組織マトリックスメタロプロテアーゼ阻害因子の阻害能を大幅に上回り、細胞外マトリックスの過剰な分解が生じます【文献4】。
- 正常組織ではマトリックスメタロプロテアーゼと阻害因子のバランスが保たれています。
- 炎症性サイトカインがマトリックスメタロプロテアーゼの発現を著しく増加させます。
- 組織マトリックスメタロプロテアーゼ阻害因子の発現は増加しないか減少します。
- マトリックスメタロプロテアーゼ活性が阻害能を大幅に上回ります。
- 細胞外マトリックスの過剰な分解が生じます。
マトリックスメタロプロテアーゼ活性の制御破綻は、赤ニキビにおける組織破壊の主要な機序です【文献4】。コラーゲン線維とエラスチン線維が分解されると、真皮の構造的完全性が損なわれ、組織強度が低下します【文献4】。さらに、基底膜の4型コラーゲンが分解されると、表皮と真皮の接着が弱まり、表皮の剥離が生じやすくなります【文献4】。このような細胞外マトリックスの分解は、赤ニキビの炎症が活動的である限り継続します【文献4】。炎症が数週間から数か月にわたり持続すると、細胞外マトリックスの分解が広範囲に及び、組織構築の不可逆的な変化をもたらします【文献4】。細胞外マトリックスの分解産物自体も、炎症性メディエーターとして機能し、炎症反応をさらに増幅します【文献4】。したがって、マトリックスメタロプロテアーゼによる細胞外マトリックス分解は、赤ニキビにおける組織破壊と炎症増幅の両方に寄与する重要な病態機序です【文献4】。
活性酸素種による酸化的組織損傷
赤ニキビにおける組織破壊には、活性酸素種による酸化的損傷も重要な役割を果たします【文献3】【文献4】。活性酸素種は、不対電子を持つ高反応性の酸素分子であり、周囲の生体分子を酸化的に損傷します【文献3】。赤ニキビの炎症部位では、好中球が活性酸素種の主要な産生源となります【文献4】。好中球は、アクネ菌を貪食すると、細胞内で酸化的バーストと呼ばれる現象を起こし、大量の活性酸素種を産生します【文献4】。産生される活性酸素種には、スーパーオキシドアニオン、過酸化水素、ヒドロキシルラジカル、次亜塩素酸などが含まれます【文献3】。これらの活性酸素種は、細菌を殺菌する一方、周囲の正常組織をも酸化的に損傷します【文献3】【文献4】。特に、ヒドロキシルラジカルは極めて反応性が高く、脂質、蛋白質、核酸を無差別に酸化します【文献3】。
- 好中球が酸化的バーストを起こし大量の活性酸素種を産生します。
- スーパーオキシド、過酸化水素、ヒドロキシルラジカル、次亜塩素酸が生成されます。
- 活性酸素種が細菌を殺菌する一方で正常組織も損傷します。
- 脂質過酸化により細胞膜の構造が破壊されます。
- 蛋白質の酸化的修飾により酵素活性が失われます。
活性酸素種による脂質過酸化は、細胞膜の構造的完全性を破壊します【文献3】。細胞膜を構成する不飽和脂肪酸は、活性酸素種により容易に酸化されます【文献3】。脂質過酸化が進行すると、細胞膜の流動性が低下し、膜透過性が異常に亢進します【文献3】。この結果、細胞内外のイオン勾配が破綻し、細胞機能が障害されます【文献3】。さらに、脂質過酸化の連鎖反応により、脂質過酸化物が生成されます【文献3】。脂質過酸化物は、マロンジアルデヒドや4ヒドロキシノネナールなどのアルデヒド化合物を生成し、これらが蛋白質と反応して蛋白質の架橋と変性を引き起こします【文献3】。蛋白質の酸化的修飾により、酵素の活性が失われ、細胞機能がさらに障害されます【文献3】。このような活性酸素種による酸化的損傷は、赤ニキビの炎症部位で広範囲に生じており、組織破壊の重要な機序となります【文献3】【文献4】。
毛包周囲組織の微小循環障害
赤ニキビによる組織影響には、毛包周囲組織の微小循環障害も含まれます。炎症により血管透過性が亢進すると、血漿成分が血管外へ漏出し、組織浮腫が形成されます【文献3】。組織浮腫は、組織間質圧を上昇させ、この間質圧上昇が微小血管を圧迫します【文献3】。微小血管が圧迫されると、血流が障害され、組織への酸素と栄養の供給が低下します【文献3】。この微小循環障害は、組織の低酸素状態を引き起こし、細胞機能を障害します【文献3】。さらに、炎症により血管内皮細胞が活性化されると、血管内皮細胞が産生する血管拡張因子と血管収縮因子のバランスが変化します【文献3】。通常、血管内皮細胞は一酸化窒素などの血管拡張因子を産生して血管の開通性を維持していますが、炎症により内皮細胞機能が障害されると、血管拡張因子の産生が低下します【文献3】。同時に、炎症性メディエーターが血管収縮因子の産生を促進します【文献3】。この結果、血管収縮が生じ、微小循環がさらに障害されます【文献3】。
微小循環障害は、組織の低酸素状態を悪化させ、細胞のエネルギー代謝を障害します【文献3】。細胞は、酸素を利用した好気的代謝によりエネルギーを効率的に産生しますが、低酸素状態では嫌気的代謝に依存せざるを得なくなります【文献3】。嫌気的代謝は、好気的代謝と比較してエネルギー産生効率が著しく低く、細胞機能の維持が困難となります【文献3】。さらに、嫌気的代謝により乳酸が蓄積し、組織の水素イオン濃度が上昇します【文献3】。水素イオン濃度の上昇は、酵素活性を低下させ、細胞機能をさらに障害します【文献3】。また、低酸素状態では、細胞は低酸素誘導因子と呼ばれる転写因子を活性化します【文献3】。低酸素誘導因子は、血管新生を促進する遺伝子の転写を誘導しますが、同時に炎症性メディエーターの産生も促進します【文献3】。このため、低酸素状態は炎症をさらに増悪させる可能性があります【文献3】。
血管内皮細胞の機能変化と血栓形成傾向
赤ニキビの炎症により、血管内皮細胞は構造的および機能的な変化を受けます【文献3】。炎症性サイトカインは、内皮細胞の形態を変化させ、内皮細胞が収縮して細胞間隙が拡大します【文献3】。この細胞間隙の拡大が、血管透過性亢進の直接的な機序です【文献3】。さらに、炎症性サイトカインは、内皮細胞の表面特性を変化させます【文献3】。正常な内皮細胞表面は、抗血栓性の特性を持ち、血小板の接着と凝固反応を抑制しています【文献3】。しかし、炎症により内皮細胞が活性化されると、表面に組織因子と呼ばれる凝固促進因子が発現されます【文献3】。組織因子は、外因性凝固カスケードを開始する重要な因子であり、その発現は血栓形成傾向を促進します【文献3】。さらに、活性化された内皮細胞は、フォンビルブランド因子を放出し、血小板の接着を促進します【文献3】。このような内皮細胞の機能変化により、炎症部位の微小血管では血栓形成傾向が亢進します【文献3】。
- 炎症性サイトカインが内皮細胞の形態を変化させます。
- 内皮細胞が収縮し細胞間隙が拡大して透過性が亢進します。
- 内皮細胞表面に組織因子が発現され凝固カスケードが開始されます。
- フォンビルブランド因子が放出され血小板の接着が促進されます。
- 微小血管で血栓形成傾向が亢進します。
微小血管内での血栓形成は、血流をさらに障害し、組織の虚血を悪化させます【文献3】。形成された血栓が微小血管を完全に閉塞すると、その血管が支配する組織領域への血流が完全に途絶し、組織壊死が生じる可能性があります【文献3】。このような微小血栓による組織虚血は、赤ニキビの重症例で認められることがあります【文献3】。さらに、血栓形成は炎症反応を増幅します【文献3】。血栓を構成するフィブリンは、炎症性メディエーターの産生を促進し、炎症細胞の浸潤を増強します【文献3】。また、血小板は活性化されると、血小板由来成長因子などの成長因子を放出し、線維芽細胞の増殖を促進します【文献3】。このように、血管内皮細胞の機能変化と血栓形成は、赤ニキビにおける微小循環障害と組織損傷の重要な機序です【文献3】。
神経系への影響と疼痛発生機序
赤ニキビは、しばしば圧痛や自発痛を伴います【文献5】。この疼痛は、炎症により産生されるメディエーターが皮膚の侵害受容器を刺激することで生じます【文献3】。侵害受容器は、組織損傷や有害刺激を検知する感覚神経の終末であり、真皮内に広く分布しています【文献3】。炎症性メディエーターの中で、特に疼痛惹起能が高いのは、ブラジキニン、プロスタグランジン、セロトニン、ヒスタミンです【文献3】。ブラジキニンは、最も強力な疼痛惹起物質の一つであり、侵害受容器を直接刺激して疼痛シグナルを発生させます【文献3】。プロスタグランジンは、侵害受容器の感受性を増強し、他の刺激に対する反応性を亢進させます【文献3】。この感受性増強により、通常では疼痛を引き起こさない程度の刺激でも、疼痛が感じられるようになります【文献3】。この現象は痛覚過敏と呼ばれ、赤ニキビの圧痛の主要な機序です【文献3】。
炎症により産生されるサイトカインも、神経系に作用して疼痛を修飾します【文献3】。腫瘍壊死因子とインターロイキン1は、侵害受容器の興奮性を直接増強します【文献3】。さらに、これらのサイトカインは、脊髄レベルでの疼痛信号の伝達を増強し、中枢性の痛覚過敏を誘導します【文献3】。このため、赤ニキビの疼痛は、末梢性の機序と中枢性の機序の両方により形成されます【文献3】。赤ニキビの疼痛は、炎症が活動的である期間中持続し、炎症が沈静化すると徐々に消失します【文献3】。しかし、炎症が長期間持続すると、神経系に可塑的な変化が生じ、炎症が沈静化した後も疼痛が遷延することがあります【文献3】。さらに、赤ニキビによる組織損傷が神経線維を直接障害すると、神経障害性疼痛が発生する可能性があります【文献3】。神経障害性疼痛は、通常の炎症性疼痛とは異なる性質を持ち、灼熱感や電撃痛として感じられることがあります【文献3】。
まとめ
赤ニキビは、尋常性ざ瘡における炎症性皮疹の代表的な病型であり、紅色丘疹として臨床的に観察されます。赤ニキビの本質は、毛包脂腺系における炎症反応の顕在化であり、その形成過程は皮脂分泌亢進、毛包角化異常、アクネ菌増殖、炎症惹起という四つの病態生理学的要素の複合的な作用により駆動されます。赤ニキビの形成は突然発生する現象ではなく、数週間から数か月にわたる段階的な病態進行の帰結として理解されます。この病態進行は、微小面皰の形成に始まり、閉鎖面皰、開放面皰を経て、最終的に炎症性病変である赤ニキビへと移行します。
赤ニキビの形成における最も重要な転換点は、毛包壁の破綻です。毛包壁が破綻すると、毛包内容物が真皮内へ漏出し、この漏出が炎症カスケードの開始シグナルとなります。漏出した毛包内容物に含まれるアクネ菌由来の病原体関連分子パターンは、真皮内の樹状細胞とマクロファージによりToll様受容体2を介して認識され、炎症性サイトカインの産生が開始されます。産生された腫瘍壊死因子とインターロイキン1は、血管内皮細胞を活性化し、好中球の動員を促進します。好中球は毛包周囲組織へ大量に浸潤し、アクネ菌を貪食するとともに、活性酸素種と蛋白分解酵素を放出して周囲組織を損傷します。この一連の炎症反応により、血管拡張と血管透過性亢進が生じ、赤ニキビの特徴的な紅斑と腫脹が形成されます。
アクネ菌は、赤ニキビにおける炎症惹起において中心的な役割を果たしますが、病原菌ではなく皮膚常在菌です。アクネ菌による炎症惹起は、アクネ菌の感染ではなく、アクネ菌由来の病原体関連分子パターンに対する宿主の免疫応答として理解されます。アクネ菌は、リパーゼ、プロテアーゼ、ポルフィリンなどの生物学的活性物質を産生し、これらが直接的または間接的に炎症反応を促進します。リパーゼは皮脂を分解して遊離脂肪酸を生成し、遊離脂肪酸が毛包壁を刺激して炎症を惹起します。プロテアーゼは毛包壁の蛋白質を分解し、毛包壁の脆弱性を増加させます。ポルフィリンは光感受性物質であり、光曝露下で活性酸素種を生成して組織を酸化的に損傷します。
赤ニキビによる組織影響は、急性期の変化と慢性期の変化に大別されます。急性期には、血管拡張、血管透過性亢進、炎症細胞浸潤が主体であり、これらが赤ニキビの臨床的特徴を形成します。慢性期には、持続的な炎症により組織リモデリングが進行し、真皮細胞外マトリックスの分解、線維芽細胞の増殖、血管新生などが生じます。真皮細胞外マトリックスの分解は、マトリックスメタロプロテアーゼにより媒介され、コラーゲン線維とエラスチン線維が破壊されます。この細胞外マトリックス分解は、組織の構造的完全性を損ない、炎症が遷延した場合には不可逆的な組織変化をもたらします。
赤ニキビの炎症が遷延すると、自然免疫応答に加えて適応免疫応答が活性化されます。樹状細胞はアクネ菌由来の抗原を貪食し、リンパ節でヘルパーT細胞に抗原提示を行います。活性化されたヘルパーT細胞、特にTh17細胞は、インターロイキン17を産生して好中球の動員を強力に促進します。Th17細胞の過剰な活性化は、炎症の慢性化と組織損傷の進行に寄与します。さらに、制御性T細胞の機能不全により、炎症応答の適切な制御が行われず、慢性炎症が持続します。このTh17細胞と制御性T細胞のバランス異常が、赤ニキビの慢性化と重症化の重要な機序となります。
赤ニキビは、毛包脂腺系における複雑な病態生理学的プロセスの帰結として形成される炎症性皮疹であり、その形成過程には、ホルモン、免疫、微生物、組織応答など、多様な生物学的要素が関与します。赤ニキビの病態を包括的に理解することは、この疾患の本質を把握し、患者の心理社会的健康を維持するうえで重要です。赤ニキビは単なる美容的問題ではなく、複雑な免疫学的および炎症学的機序により形成される医学的病態として認識されるべきです。
専門用語一覧
- 角質栓: 毛包内腔に蓄積した角質と皮脂の混合物です。角化細胞の過剰増殖と剥離障害により形成され、毛包を閉塞します。
- ペプチドグリカン: 細菌の細胞壁を構成する主要成分です。糖鎖とペプチド鎖が交互に結合した構造を持ち、Toll様受容体2により認識されます。
- Toll様受容体: 病原体関連分子パターンを認識する受容体ファミリーです。自然免疫応答を開始する重要な役割を果たします。
- Toll様受容体2: Toll様受容体ファミリーの一つです。アクネ菌の細胞壁成分であるペプチドグリカンとリポテイコ酸を認識して自然免疫応答を開始します。毛包上皮細胞、角化細胞、皮脂腺細胞、樹状細胞、マクロファージなどに発現しています。
- 炎症性メディエーター: 炎症反応を媒介する物質の総称です。サイトカイン、ケモカイン、プロスタグランジンなどが含まれます。
- 炎症性サイトカイン: 炎症反応を促進する蛋白質メディエーターです。腫瘍壊死因子、インターロイキン1、インターロイキン6、インターロイキン8などが含まれます。
- サイトカイン: 細胞間の情報伝達を担う蛋白質の総称です。免疫応答、炎症反応、細胞増殖などを調節します。
- ケモカイン: 細胞の走化性を誘導するサイトカインです。炎症細胞を炎症部位へ動員する役割を果たします。インターロイキン8が代表的なケモカインです。
- 腫瘍壊死因子: 強力な炎症惹起サイトカインです。血管内皮細胞を活性化し、接着分子の発現を誘導して好中球の動員を促進します。
- インターロイキン: 白血球間の情報伝達を担うサイトカインの総称です。番号により多数の種類が存在し、それぞれ異なる機能を持ちます。
- インターロイキン17: Th17細胞が産生するサイトカインです。好中球の動員を強力に促進し、炎症の慢性化に寄与します。
- インターフェロン: ウイルス感染に対する防御に重要なサイトカインです。抗ウイルス応答を誘導するとともに、免疫細胞を活性化します。
- 転写因子: 遺伝子の転写を調節する蛋白質です。核内でDNAに結合し、特定の遺伝子の発現を促進または抑制します。
- 走化性: 化学物質の濃度勾配に従って細胞が移動する現象です。ケモカインが走化性を誘導し、炎症細胞を炎症部位へ動員します。
- 貪食: 細胞が細菌や組織破片などを取り込む過程です。好中球とマクロファージが主要な貪食細胞です。
- 酸化的バースト: 好中球が細菌を貪食した際に、大量の活性酸素種を産生する現象です。産生された活性酸素種により細菌が殺菌されます。
- 血管拡張: 血管平滑筋が弛緩して血管が拡張する現象です。炎症性メディエーターが血管平滑筋に作用して血管拡張を引き起こし、組織への血流が増加します。
- 血管透過性亢進: 血管壁の透過性が増加した状態です。炎症性メディエーターが血管内皮細胞に作用して細胞間隙が拡大し、血漿成分が血管外へ漏出します。
- 血管内皮細胞: 血管の内腔を覆う細胞です。血管壁の透過性を制御し、血液凝固と炎症反応を調節します。
- 血管平滑筋: 血管壁を構成する平滑筋です。収縮と弛緩により血管の口径を調節します。
- 組織浮腫: 組織間質に水分と蛋白質が蓄積した状態です。血管透過性亢進により血漿成分が血管外へ漏出して形成されます。
- 組織間質: 細胞間を満たす空間です。細胞外マトリックスと組織液から構成されます。
- 膠質浸透圧: 蛋白質による浸透圧です。血漿蛋白が血管外へ漏出すると、組織間質の膠質浸透圧が上昇し、水分移動が促進されます。
- マトリックスメタロプロテアーゼ: 細胞外マトリックスを分解する酵素ファミリーです。コラーゲン、エラスチン、プロテオグリカンを分解します。炎症性サイトカインにより発現が誘導されます。
- 組織マトリックスメタロプロテアーゼ阻害因子: マトリックスメタロプロテアーゼの活性を阻害する内因性の蛋白質です。正常な組織では、マトリックスメタロプロテアーゼと組織マトリックスメタロプロテアーゼ阻害因子のバランスが保たれています。
- 細胞外マトリックス: 細胞間を満たす構造物です。コラーゲン線維、エラスチン線維、プロテオグリカンなどから構成され、組織の構造的完全性と機械的強度を維持します。
- リパーゼ: 脂質を分解する酵素です。トリグリセリドを遊離脂肪酸とグリセロールに分解します。アクネ菌はリパーゼを産生し、皮脂中のトリグリセリドを分解します。
- プロテアーゼ: 蛋白質を分解する酵素です。アクネ菌はプロテアーゼを産生し、毛包壁を構成する蛋白質を分解して毛包壁の脆弱性を増加させます。
- アクネ菌プロテアーゼ: アクネ菌が産生するプロテアーゼを指す本記事独自の便宜上の表現です。コラーゲンとエラスチンを分解する能力を持ちます。
- ヒアルロニダーゼ: ヒアルロン酸を分解する酵素です。アクネ菌はヒアルロニダーゼを産生し、真皮のヒアルロン酸を分解して炎症の拡散を促進します。
- ポルフィリン: 光感受性物質です。環状の構造を持つ色素であり、ヘムの前駆体です。アクネ菌はコプロポルフィリンとプロトポルフィリンを産生します。
- コプロポルフィリン: アクネ菌が産生するポルフィリンの一種です。可視光線や紫外線に曝露されると励起され、活性酸素種を生成します。
- プロトポルフィリン: アクネ菌が産生するポルフィリンの一種です。光感受性が高く、光曝露下で組織損傷を引き起こします。
- 一重項酸素: 励起状態の酸素分子です。ポルフィリンが光曝露により励起されると、周囲の酸素分子を一重項酸素に変換します。一重項酸素は強力な酸化剤であり、細胞を損傷します。
- 細胞外小胞: 細菌が放出する膜小胞です。直径50〜200nm程度であり、細菌由来の多様な分子を含んでいます。アクネ菌由来の細胞外小胞は、炎症惹起において重要な役割を果たします。
- 補体系: 細菌を直接殺菌するとともに、炎症反応を増幅する免疫機構です。
- 補体断片: 補体系が活性化されて生成される蛋白質断片です。好中球やマクロファージを活性化し、炎症部位への動員を促進します。
- インスリン様成長因子: 細胞の増殖と分化を促進する成長因子です。皮脂腺細胞の増殖と脂質合成を促進します。
- デスモソーム: 角化細胞間の主要な接着構造です。細胞膜を貫通する接着分子と細胞内のトノフィラメントから構成され、細胞間を強固に接着します。
- 組織間質圧: 組織間質内の圧力です。組織浮腫により上昇し、微小血管を圧迫して血流を障害します。
- 微小循環: 毛細血管レベルでの血液循環です。組織への酸素と栄養の供給、老廃物の除去を担います。
- 低酸素状態: 組織への酸素供給が不足した状態です。微小循環障害により生じ、細胞のエネルギー代謝を障害します。
- 嫌気的代謝: 酸素を利用しない代謝経路です。低酸素状態では、細胞は嫌気的代謝に依存せざるを得なくなりますが、エネルギー産生効率が著しく低くなります。
- 好気的代謝: 酸素を利用する代謝経路です。効率的にエネルギーを産生することができます。
- 低酸素誘導因子: 低酸素状態で活性化される転写因子です。血管新生を促進する遺伝子の転写を誘導しますが、同時に炎症性メディエーターの産生も促進します。
- フォンビルブランド因子: 血小板の接着を促進する蛋白質です。活性化された内皮細胞から放出されます。
- 侵害受容器: 組織損傷や有害刺激を検知する感覚神経の終末です。真皮内に広く分布しています。
- ブラジキニン: 強力な疼痛惹起物質です。炎症部位で産生され、侵害受容器を直接刺激します。
- プロスタグランジン: 炎症性メディエーターの一つです。侵害受容器の感受性を増強し、痛覚過敏を引き起こします。
参考文献一覧
- Zouboulis CC, Jourdan E, Picardo M. Acne is an inflammatory disease and alterations of sebum composition initiate acne lesions. J Eur Acad Dermatol Venereol. 2014;28(5):527-532.
- Makrantonaki E, Ganceviciene R, Zouboulis C. An update on the role of the sebaceous gland in the pathogenesis of acne. Dermatoendocrinol. 2011;3(1):41-49.
- Dréno B, Pécastaings S, Corvec S, Veraldi S, Khammari A, Roques C. Cutibacterium acnes (Propionibacterium acnes) and acne vulgaris: a brief look at the latest updates. J Eur Acad Dermatol Venereol. 2018;32(Suppl 2):5-14.
- Tanghetti EA. The role of inflammation in the pathology of acne. J Clin Aesthet Dermatol. 2013;6(9):27-35.
- Zaenglein AL, Pathy AL, Schlosser BJ, et al. Guidelines of care for the management of acne vulgaris. J Am Acad Dermatol. 2016;74(5):945-973.
- Fitz-Gibbon S, Tomida S, Chiu BH, et al. Propionibacterium acnes strain populations in the human skin microbiome associated with acne. J Invest Dermatol. 2013;133(9):2152-2160.
- Burkhart CG, Burkhart CN. Expanding the microcomedone theory and acne therapeutics: Propionibacterium acnes biofilm produces biological glue that holds corneocytes together to form plug. J Am Acad Dermatol. 2007;57(4):722-724.
執筆者
中濵数理2-300x294.png)
■博士(工学)中濵数理
- 由風BIOメディカル株式会社 代表取締役社長
- 沖縄再生医療センター:センター長
- 一般社団法人日本スキンケア協会:顧問
- 日本再生医療学会:正会員
- 特定非営利活動法人日本免疫学会:正会員
- 日本バイオマテリアル学会:正会員
- 公益社団法人高分子学会:正会員
- X認証アカウント:@kazu197508