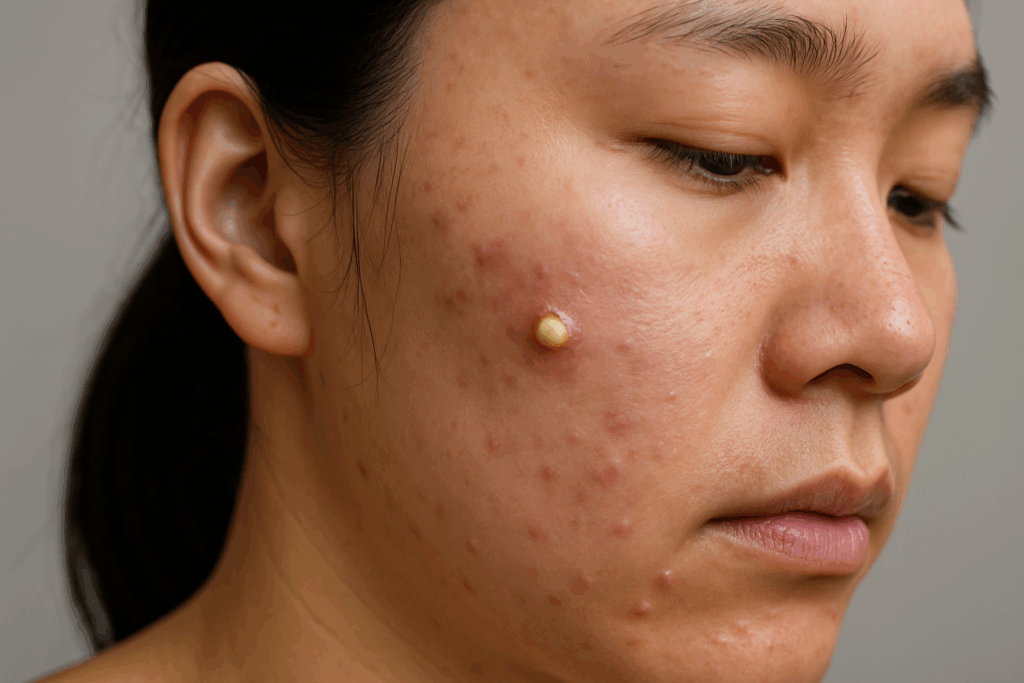
白ニキビは、医学的には閉鎖面皰(へいさめんぽう)と呼ばれ、毛穴の開口部が閉じた状態で皮脂と角質が貯留することによって生じます。この状態は尋常性痤瘡、いわゆるニキビの最も初期段階に位置づけられ、炎症を伴わない非炎症性皮疹として観察されます。白ニキビは直径1〜3mm程度の皮膚色または白色調の触知可能な小隆起として現れ、遠目には目立ちにくいものの、触診すると明確な硬結として確認できます。閉鎖面皰の内部には、毛包漏斗部に貯留した皮脂、剥離した角化細胞、細菌などが混在しており、これらが毛穴内で圧縮されることで特徴的な構造が形成されます。
白ニキビの形成過程を理解するためには、毛包脂腺系の正常な生理機能と、その破綻によって生じる病理学的変化を把握する必要があります。毛包脂腺系は皮脂腺、毛包漏斗部、毛幹から構成され、通常は皮脂が毛孔から円滑に排出される仕組みを持っています。しかし、何らかの要因によって毛包漏斗部の角化細胞が過剰に増殖し、さらにこれらの細胞が正常に剥離せずに凝集すると、毛孔の開口部が狭窄または閉塞します。この結果、皮脂腺から分泌される皮脂が毛包内に蓄積し、閉鎖面皰という病態が成立します。この段階では炎症反応は生じておらず、皮膚組織への顕著な損傷もないため、適切に対処すれば痕を残さず治癒させることが可能です。
白ニキビの病態を正確に理解することは、その後の炎症性ニキビへの進展メカニズムを解明し、病態の本質を明らかにするうえで不可欠です。閉鎖面皰は、放置すると内部に侵入したアクネ菌の増殖により炎症性皮疹へと移行し、紅色丘疹や膿疱を形成する可能性があります。また、炎症が進行すると瘢痕形成のリスクも高まります。本記事では、白ニキビの病態生理、形成メカニズム、関連する分子生物学的知見を詳細に解説し、この病態の本質を明らかにします。
ニキビの種類と形成機序
- 白ニキビの病態と形成メカニズム—閉鎖面皰はいかにして生じるのか
- 黒ニキビの病態と形成メカニズム—開放面皰はいかにして生じるのか
- 赤ニキビの病態と形成メカニズム—紅色丘疹はいかにして生じるのか
- 黄ニキビの病態と形成メカニズム—膿疱はいかにして生じるのか
白ニキビの定義と臨床的特徴
白ニキビは尋常性痤瘡における非炎症性皮疹の代表的な病型であり、医学用語では閉鎖面皰(へいさめんぽう)として分類されます。この病変は毛包脂腺系の開口部が角質と皮脂によって閉塞し、毛包内に内容物が貯留した状態を指します。閉鎖面皰は皮膚表面に白色または皮膚色の小丘疹として観察され、その直径は通常1〜3mm程度の触知可能な病変です。触診では硬い塊として触知され、視診では表面が滑らかで光沢を持つ微小な隆起として認識されます。炎症所見を伴わないため、紅斑、腫脹、疼痛、瘙痒感などの症状は通常みられません。
白ニキビの病態を理解するうえで重要なのは、毛包脂腺系における管腔の過角化という現象です。この過角化は、毛包漏斗部および皮脂腺導管における角化細胞の過剰増殖と異常な剥離によって特徴づけられ、微小面皰として組織学的に、また臨床的には白ニキビ、黒ニキビ、巨大面皰などの多様な形態として観察されます【文献1】。微小面皰はニキビ病変の数とサイズとの間に有意な相関を示し、その存在は面皰形成の程度を測る指標となります【文献1】。この相関関係はシアノアクリレートゲルを用いた皮膚表面生検によって実証されており、この手法では皮膚表面にゲルを塗布し、ガラススライドを1分間押し付けた後に剥離することで、角層上層部と微小面皰を採取し、低倍率顕微鏡またはデジタル画像解析で評価します【文献1】。
白ニキビの組織学的構造は、毛包漏斗部の拡張と角質物質の充満を特徴とします。面皰は毛包内に皮脂の栓が詰まった状態であり、皮膚表面で毛包が開いているか閉じているかによって開放面皰または閉鎖面皰と呼ばれます。閉鎖面皰は炎症性ニキビの前駆病変であり、開放面皰からは皮脂の栓を容易に圧出できますが、閉鎖面皰から除去することは比較的困難です【文献1】。面皰は毛包内における角化細胞の過剰増殖と異常な剥離から生じており、この過剰増殖は3H-チミジン標識の増加およびKi-67標識指数の上昇によって確認されています【文献1】。
閉鎖面皰形成の組織学的基盤
閉鎖面皰の形成における中心的な病態は、毛包漏斗部における角化異常です。この角化異常は電子顕微鏡的に保持型過角化として観察され、ケラトヒアリン顆粒の数とサイズの増加、脂肪滴の蓄積、そして圧力作用の結果として保持された扁平上皮が自己に折り畳まれる像が特徴的です【文献2】。正常な毛包では角化細胞は規則的に産生され、分化しながら毛包内腔へと移動し、最終的には皮脂とともに毛孔から排出されます。しかし、閉鎖面皰では毛包導管における角化細胞の増殖速度が亢進しており、管腔内への角化細胞の蓄積が過剰となります。
面皰における角化細胞の過剰増殖は、管腔内での角化細胞と角質細胞の保持を意味します。この過剰増殖は3H-チミジン標識の増加によって実証されており、さらに管腔角化細胞のKi-67標識の増加によっても確認されています【文献1】。Ki-67は細胞増殖のマーカーであり、その発現増加は管腔上皮における細胞周期の活性化を示唆します。Ki-67は細胞周期のG1、S、G2、M期に発現する核抗原であり、細胞増殖の信頼性の高いマーカーです【文献4】。正常毛包からニキビ病変部位における管腔角化細胞のKi-67陽性率は17.40%±1.86%であり、非病変部皮膚の管腔角化細胞においても増殖の亢進が実証されており、白ニキビ形成の準備段階が臨床的に正常に見える皮膚でも進行していることが明らかになっています【文献4】。
毛包漏斗部における角化細胞動態
毛包漏斗部の角化細胞は、基底層から産生され、有棘層、顆粒層を経て角層へと分化します。閉鎖面皰では、この分化過程において複数の異常が生じています。第一に、角化細胞の増殖速度が正常毛包に比べて有意に上昇しており、これが管腔内への角化細胞の過剰な供給をもたらします。第二に、角化細胞間の接着性が亢進しており、デスモソームの過剰な発達とトノフィラメントの増加が観察されます。この結果、角化細胞が正常に剥離されず、管腔内で凝集して角質栓を形成します。
- ケラトヒアリン顆粒の数とサイズが増加し、角化細胞内の構造変化が顕著となります【文献2】。
- 角化細胞内に脂肪滴が蓄積し、細胞内脂質代謝の異常が示唆されます【文献2】。
- 保持された扁平上皮が圧力により自己に折り畳まれ、緻密な角質構造を形成します【文献2】。
- 層板顆粒の減少により、正常な角質細胞間脂質の形成が障害されます【文献2】。
- 角化細胞間の凝集性亢進により、管腔内での角質栓形成が促進されます。
これらの超微形態学的変化は、閉鎖面皰における角化異常の本質を示しています。ケラトヒアリン顆粒の増加は角化細胞の分化過程における異常を反映しており、層板顆粒の減少は角質細胞間脂質の産生低下を意味します【文献2】。角質細胞間脂質は正常な角質剥離に必須であり、その減少は角化細胞の凝集性亢進と角質栓形成に直接関与します。また、角化細胞内への脂肪滴蓄積は、毛包内環境における脂質代謝の異常を示唆しており【文献2】、皮脂組成の変化が角化異常を増悪させる可能性が考えられます。
微小面皰から閉鎖面皰への進展
白ニキビの形成過程は、微小面皰という組織学的にのみ検出可能な初期病変から始まります。微小面皰は毛包漏斗部の軽度な拡張と角質物質の蓄積を特徴とし、この段階では臨床症状はなく、患者自身が病変の存在を認識することはありません。微小面皰の検出にはシアノアクリレートゲルを用いた皮膚表面剥離法が有用であり、この方法で採取された標本を顕微鏡的に評価することで、臨床的に正常に見える皮膚における面皰形成の早期段階を把握できます【文献1】。
- 微小面皰は組織学的にのみ検出される初期病変であり、毛包漏斗部の軽度拡張を示します【文献1】。
- 微小面皰の数とサイズはニキビの重症度と正の相関を示し、面皰形成の程度を測る指標となります【文献1】。
- シアノアクリレートゲル法により、非病変部皮膚からも微小面皰が検出されます【文献1】。
- 微小面皰は閉鎖面皰または開放面皰へと進展し、臨床的に視認可能な病変となります。
- 面皰形成の周期的な成長と消退が観察され、毛周期と類似した動態を示します。
微小面皰から成熟した閉鎖面皰への進展過程では、毛包漏斗部の拡張が徐々に進行し、角質と皮脂の蓄積が増大します。この過程において、毛孔の開口部は狭小化し、最終的には角質栓によって完全に閉塞されます。閉塞が完成すると、皮脂腺から分泌される皮脂は毛包内に閉じ込められ、内圧の上昇により毛包壁が伸展します。この段階で、白ニキビは臨床的に視認可能な白色の小丘疹として観察されるようになります。微小面皰から閉鎖面皰への進展には通常数週間を要し、この間に病態は段階的に進行します。
白ニキビにおける皮脂の役割
白ニキビの形成において、皮脂は角質とともに毛包内容物の主要な構成成分です。皮脂腺から分泌される皮脂は通常、毛孔を通じて皮膚表面へと排出されますが、閉鎖面皰では毛孔の閉塞により皮脂が毛包内に貯留します。貯留した皮脂は角質と混在し、毛包内腔を満たす緻密な塊を形成します。皮脂の組成変化、特にリノール酸の相対的な減少は、毛包における角化異常を誘導する要因として注目されています。皮脂分泌が増加すると、毛包上皮内のリノール酸濃度が低下し、これが毛包過角化と上皮機能の低下を引き起こすと考えられています。
閉鎖面皰内に貯留した皮脂は、嫌気的環境下で徐々に生化学的変化を受けます。毛孔が閉塞することで毛包内は酸素濃度が低下し、嫌気性細菌であるアクネ菌の増殖に適した環境が形成されます。アクネ菌はリパーゼを産生し、皮脂中のトリグリセリドを分解して遊離脂肪酸を生成します。遊離脂肪酸は毛包壁に対して刺激性を持ち、炎症反応を惹起する潜在的な能力を有します。この段階で白ニキビは炎症性病変への移行リスクが高まり、紅色丘疹や膿疱へと進展する可能性が生じます。
皮脂組成と角化異常の関連
皮脂の量的増加だけでなく、その質的変化も白ニキビの形成に関与しています。特に、皮脂中のリノール酸濃度の低下は、毛包上皮における角化異常を誘導する重要な因子です。リノール酸は必須脂肪酸であり、正常な角化細胞の分化と剥離に必要とされます。皮脂分泌が亢進すると、皮脂中および表皮脂質中のリノール酸濃度が相対的に低下し、これが毛包過角化と上皮バリア機能の低下を引き起こします。皮脂の質的変化は角化細胞の分化を変化させ、インターロイキン1の分泌を誘導し、毛包過角化の発生に寄与します【文献2】。
- 皮脂分泌の亢進により、毛包上皮内のリノール酸濃度が相対的に低下します。
- リノール酸の低下は角化細胞の異常な分化を誘導し、毛包過角化を促進します。
- 皮脂組成の変化はインターロイキン1の分泌を誘導し、毛包過角化の発生に寄与します【文献2】。
- 角質中のセラミド組成も変化しており、正常な角質剥離が障害されます。
- 皮脂とその分解産物は毛包内環境を変化させ、細菌増殖を促進します。
皮脂組成の質的変化は、角化細胞の分化過程に直接影響を及ぼします。リノール酸の欠乏は角化細胞の分化を異常な方向へ誘導し、ケラトヒアリン顆粒の過剰産生と層板顆粒の減少をもたらします。さらに、皮脂の質的変化はインターロイキン1などの炎症性サイトカインの分泌を刺激し、これが毛包過角化をさらに増悪させます【文献2】。このように、皮脂の量的・質的変化は角化異常を介して白ニキビの形成に中心的な役割を果たしており、皮脂分泌の制御は白ニキビの病態理解において重要な要素となります。
白ニキビの形成メカニズム—毛包脂腺系の病態生理
白ニキビの形成メカニズムを理解するためには、毛包脂腺系における一連の病態生理学的変化を把握する必要があります。閉鎖面皰の形成は単一の要因ではなく、角化細胞の増殖異常、角質細胞間の凝集性亢進、皮脂分泌の変化、そして毛包内微小環境の変化という複数の要因が相互に作用することで成立します。これらの要因は独立して作用するのではなく、相互に影響を及ぼしながら閉鎖面皰の形成を促進します。特に重要なのは、毛包漏斗部における管腔角化細胞の過剰増殖であり、これが白ニキビ形成の最も重要な初期イベントとされています【文献2】。
毛包漏斗部および皮脂腺導管における過角化は、微小面皰という形で始まります。電子顕微鏡的には、過角化のパターンは保持型過角化として観察され、ケラトヒアリン顆粒の数とサイズの増加、脂肪滴の蓄積、そして保持された扁平上皮が圧力作用により自己に折り畳まれる像が特徴的です【文献2】。この過角化は毛包漏斗部の下部で最初に観察され、その後毛包全体に広がります。角質物質は緻密となり、細胞内脂肪滴が蓄積し、ケラトヒアリン顆粒の数とサイズが増加する一方で、層板顆粒は減少し、これが面皰形成へと導きます【文献2】。
閉鎖面皰における角化細胞の増殖は、正常毛包と比較して有意に亢進しています。面皰における角化細胞の増殖は正常毛包よりも高く、漏斗部角化細胞はより凝集性が高い状態を示します【文献2】。この過剰増殖と凝集性の亢進が組み合わさることで、角化細胞は毛包内腔に蓄積し、管腔を閉塞させる角質栓を形成します。角質栓は皮脂の排出を妨げ、毛包内に皮脂が貯留することで白ニキビという臨床像が完成します。このプロセスは数週間から数ヶ月かけて進行し、微小面皰から臨床的に視認可能な閉鎖面皰へと発展します。
角化細胞の増殖制御機構の破綻
白ニキビの形成における中心的な病態は、毛包漏斗部における角化細胞の増殖制御機構の破綻です。正常な毛包では、角化細胞の増殖と分化は厳密に制御されており、基底層で産生された角化細胞は規則的に分化しながら上層へ移動し、最終的には角層として剥離されます。しかし、閉鎖面皰ではこの制御機構が破綻しており、角化細胞の増殖速度が異常に亢進します。この増殖亢進は3H-チミジン標識の増加によって実証されており、DNA合成期にある細胞の割合が正常毛包に比べて有意に高いことが示されています【文献1】。
さらに、Ki-67抗原を用いた免疫組織化学的検討により、面皰における管腔角化細胞の増殖マーカー陽性率が正常毛包よりも高いことが確認されています【文献4】。Ki-67は細胞周期のG1、S、G2、M期に発現する核抗原であり、細胞増殖の信頼性の高いマーカーです。面皰におけるKi-67標識指数の上昇は、管腔上皮において活発な細胞増殖が進行していることを意味します。興味深いことに、この技術は非病変部皮膚の管腔角化細胞においても増殖の亢進を実証しており、臨床的に正常に見える皮膚でも白ニキビ形成の準備段階が進行していることを示しています【文献4】。
角化細胞増殖を制御する因子
毛包漏斗部における角化細胞の増殖は、複数の因子によって制御されています。正常状態では、これらの因子が均衡を保つことで適切な増殖速度が維持されますが、白ニキビ形成時にはこの均衡が崩れ、増殖促進因子が優位となります。アンドロゲンは皮脂腺を刺激して皮脂分泌を増加させるだけでなく、毛包漏斗部の角化細胞に直接作用して増殖を促進します。サイトカイン、特にインターロイキン1は角化細胞の増殖と分化を調節し、毛包過角化の発生に関与します【文献2】。
- アンドロゲンは毛包漏斗部の角化細胞に作用し、増殖を促進します。
- インターロイキン1などのサイトカインは角化細胞の分化を変化させ、過角化を誘導します【文献2】。
- 皮脂の質的変化、特にリノール酸の欠乏は角化異常を引き起こします。
- 成長因子やその受容体の異常も角化細胞の増殖亢進に関与する可能性があります。
- 細胞周期制御タンパク質の発現変化が増殖速度の亢進をもたらします。
これらの因子の中でも、サイトカインによる制御機構は特に重要です。インターロイキン1は角化細胞から分泌される炎症性サイトカインであり、角化細胞の分化を促進するとともに、増殖にも影響を及ぼします。皮脂中の脂質組成の質的変化は角化細胞の分化を変化させ、インターロイキン1の分泌を誘導し、毛包過角化の発生に寄与します【文献2】。このように、皮脂の質的変化とサイトカインの分泌は相互に関連しており、これらが複合的に作用することで角化細胞の増殖亢進と分化異常が生じ、白ニキビの形成が促進されます。
角化細胞間凝集性の亢進機序
白ニキビの形成において、角化細胞の増殖亢進と並んで重要なのが、角化細胞間の凝集性の亢進です。正常な毛包では、角化細胞は適切なタイミングで細胞間接着を解除し、管腔内に剥離されます。しかし、閉鎖面皰では角化細胞間の接着構造が異常に発達しており、細胞間の凝集性が著しく亢進しています。デスモソームは角化細胞間の主要な接着構造であり、トノフィラメントと結合して強固な細胞間結合を形成します。閉鎖面皰ではデスモソームの数と大きさが増加しており、これが角化細胞の異常な凝集をもたらします。
- デスモソームの数と大きさが増加し、角化細胞間の接着が強化されます。
- トノフィラメントの過剰な発達により、細胞骨格構造が強化されます。
- 層板顆粒の減少により、角質細胞間脂質の産生が低下します【文献2】。
- 角質細胞間脂質の異常は正常な細胞剥離を妨げ、凝集性を亢進させます。
- 角化細胞内への脂肪滴蓄積が細胞間接着に影響を及ぼす可能性があります【文献2】。
角化細胞間の凝集性亢進において、層板顆粒の減少は重要な役割を果たしています。層板顆粒は角質細胞間脂質の前駆体を含む細胞小器官であり、顆粒層で細胞外へ放出されることで角質層の脂質バリアを形成します。閉鎖面皰では層板顆粒が減少しており、これが角質細胞間脂質の産生低下をもたらします【文献2】。角質細胞間脂質は正常な角質剥離に必須であり、その減少は角化細胞の凝集性を亢進させ、管腔内での角質栓形成を促進します。このように、角化細胞間の接着構造の異常と脂質代謝の変化が複合的に作用することで、白ニキビにおける角質栓形成が完成します。
毛包内微小環境の変化
白ニキビの形成過程において、毛包内の微小環境は大きく変化します。毛孔が角質栓によって閉塞されると、毛包内は外界から隔離された閉鎖空間となり、酸素濃度、pH、微生物叢、生化学的環境が正常毛包とは異なる状態へと変化します。特に重要なのは酸素濃度の低下であり、毛孔の閉塞により毛包内は嫌気的環境となります。この環境変化は、毛包内に常在するアクネ菌などの嫌気性細菌の増殖を促進します。閉鎖面皰の形成においては、炎症イベントが病変の開始に関与しており、微小面皰段階ですでに炎症性メディエーターが検出されることが報告されています【文献3】。
閉鎖面皰内では、貯留した皮脂が徐々に生化学的変化を受けます。アクネ菌はリパーゼを産生し、皮脂中のトリグリセリドを分解して遊離脂肪酸を生成します。遊離脂肪酸は毛包壁に対して刺激性を持ち、炎症反応を惹起する能力を有します。さらに、アクネ菌はプロテアーゼ、ホスファターゼ、ヒアルロン酸分解酵素、エンドグリコセラミダーゼ、ノイラミニダーゼなどの多様な酵素を産生し、これらが毛包、皮脂腺、真皮細胞外マトリックスを障害します。微小面皰段階では組織学的に明らかな炎症所見はみられないものの、インターロイキン1αのような炎症性メディエーターが既に存在していることが確認されています【文献3】。
閉鎖面皰内における生化学的変化
閉鎖面皰内では、皮脂と角質が混在した環境において複雑な生化学的変化が進行します。貯留した皮脂は時間経過とともに酸化され、また細菌由来の酵素によって分解されます。これらの変化により、毛包内の化学的環境は正常毛包とは大きく異なるものとなります。特に、リパーゼによる脂質分解は遊離脂肪酸の蓄積をもたらし、これが毛包壁の刺激の重要な因子となります。遊離脂肪酸の中でも、オレイン酸やパルミチン酸などの飽和および不飽和脂肪酸は、角化細胞に対して直接的な刺激作用を持ちます。
- アクネ菌由来のリパーゼが皮脂中のトリグリセリドを分解し、遊離脂肪酸を生成します。
- 遊離脂肪酸は毛包壁に対して刺激性を持ち、角化細胞の機能に影響を及ぼします。
- プロテアーゼやその他の酵素が毛包上皮と真皮マトリックスを分解します。
- 毛包内のpHが変化し、これが微生物叢の組成と酵素活性に影響を及ぼします。
- 酸素濃度の低下により嫌気性細菌の増殖が促進され、代謝産物が蓄積します。
閉鎖面皰内における生化学的変化は、白ニキビの病態を維持し、さらに増悪させる要因となります。遊離脂肪酸の蓄積は毛包壁の角化細胞を刺激し、これらの細胞からインターロイキン6、インターロイキン8などの炎症性サイトカインの分泌を誘導します。さらに、アクネ菌の細胞壁成分や分泌物は、毛包周囲の免疫細胞を活性化させる能力を持ちます。炎症イベントは面皰病変の開始に関与しており、微小面皰段階で既にインターロイキン1αが検出されることから、炎症は白ニキビ形成の初期段階から存在していることが示唆されています【文献3】。このように、閉鎖面皰内の生化学的変化は多岐にわたり、これらが複合的に作用することで白ニキビの病態が形成され維持されます。
毛包周囲組織における構造変化
白ニキビの形成は毛包内腔の変化にとどまらず、毛包周囲の真皮組織にも構造的変化をもたらします。閉鎖面皰では、毛包壁の内圧が上昇することで毛包上皮が伸展し、一部では上皮の菲薄化や微小な断裂が生じます。この結果、毛包内容物の一部が真皮内へ漏出し、毛包周囲に軽度の炎症性細胞浸潤を引き起こすことがあります。この段階では臨床的に明らかな炎症所見は認められませんが、組織学的には毛包周囲にリンパ球やマクロファージの軽度浸潤が観察されることがあります。
- 毛包内圧の上昇により毛包壁が伸展し、上皮が菲薄化します。
- 毛包上皮の微小断裂により内容物が真皮内へ漏出する可能性があります。
- 毛包周囲にリンパ球やマクロファージの軽度浸潤が生じることがあります。
- 真皮における血管拡張や軽度の浮腫が観察される場合があります。
- 毛包外膜の肥厚や膠原線維の沈着が進行することがあります。
毛包周囲組織におけるこれらの構造変化は、白ニキビの病態の進行を反映しています。毛包内容物の真皮内漏出は、免疫系の活性化を引き起こします。特に、アクネ菌の菌体成分や遊離脂肪酸は免疫原性を持ち、真皮内へ漏出することで免疫応答を惹起します。毛包外膜の肥厚や膠原線維の沈着は、慢性的な機械的刺激や軽度の炎症反応の結果として生じ、毛包構造の恒久的な変化をもたらす可能性があります。炎症イベントは面皰病変の開始に関与しており、微小面皰段階から既に炎症性メディエーターが存在することが確認されています【文献3】。このように、白ニキビは単なる毛包内腔の閉塞にとどまらず、毛包周囲組織を含む広範な構造変化を伴う病態です。
白ニキビにおける炎症反応の始動機構
白ニキビは臨床的には非炎症性皮疹として分類されますが、分子レベルおよび組織学的レベルでは、病変形成の初期段階から炎症性イベントが関与していることが明らかになっています。従来、閉鎖面皰は純粋に非炎症性の病変であり、炎症反応は細菌感染が加わった後期段階で初めて生じると考えられてきました。しかし、近年の研究により、炎症イベントは面皰病変の開始に関与していることが確認されています【文献3】。面皰内における炎症性サイトカインの検出により、この概念は大きく修正されました。開放面皰を用いた研究では、76%の面皰において生物活性を持つインターロイキン1α様物質が検出されており、その濃度は23〜4765pg/mg面皰物質の範囲に及びます【文献5】。
この発見は白ニキビの病態理解における重要なパラダイムシフトをもたらしました。インターロイキン1αは強力な炎症性サイトカインであり、角化細胞の増殖と分化、接着分子の発現、他のサイトカインの産生を調節する多面的な作用を持ちます。面皰内の生物活性を持つインターロイキン1α様物質は、毛包脂腺系壁の海綿状変化または破裂後のニキビにおける炎症の開始に関与している可能性があります【文献5】。さらに、以前の報告では、皮脂腺導管の角化細胞によるサイトカインインターロイキン1αの放出が面皰のライフサイクルにおいて極めて重要であり、その発生と自然消退の両方を媒介すると報告されています【文献6】。
白ニキビにおける炎症反応の始動機構を理解するうえで、Toll様受容体を介したシグナル伝達が重要な役割を果たします。Toll様受容体は、微生物が提示する病原体関連分子パターンを認識する分子ファミリーであり、抗菌化合物とサイトカインの放出で終結するシグナル伝達カスケードを開始します【文献6】。アクネ菌は、Toll様受容体2に作用することにより、毛包角化細胞によるインターロイキン6やインターロイキン8などのサイトカインの分泌、およびマクロファージにおけるインターロイキン8と12の分泌を刺激し、炎症を引き起こす可能性があります【文献2】。このように、白ニキビにおける炎症反応は、病変形成の初期から存在し、その後の病態進展に決定的な役割を果たしています。
面皰におけるインターロイキン1αの検出と意義
インターロイキン1αは、白ニキビの形成初期段階における最も重要な炎症性メディエーターです。開放面皰108個を18人の未治療ニキビ患者から採取した研究では、各面皰を均質化し遠心分離した後、上清中の生物活性を持つインターロイキン1α、インターロイキン1β、TNFαおよび免疫化学的に検出可能なこれらのサイトカインが分析されました【文献5】。その結果、76%の開放面皰において生物活性を持つインターロイキン1α様物質が検出され、その濃度は23〜4765pg/mg面皰物質の範囲でした。58%の面皰では100pg/mgを超える濃度が認められました【文献5】。
対照的に、生物活性を持つインターロイキン1βはいずれの面皰からも検出されませんでした。24%の面皰には低レベルの免疫化学的インターロイキン1β(12〜103pg/mg面皰物質)が含まれていました【文献5】。生物活性を持つTNFαは3個の面皰で検出され、さらに5個の面皰で免疫化学的TNFα(61〜820pg/mg面皰物質の範囲)が検出されました【文献5】。これらの結果は、インターロイキン1αが面皰における主要な炎症性メディエーターであることを示しています。炎症イベントは面皰病変の開始に関与しており【文献3】、インターロイキン1αがその中心的な役割を果たしていることが示唆されます。
インターロイキン1αと微生物数との関係
面皰内の炎症性サイトカインと微生物数との関係を調べるため、面皰ペレット中のプロピオニバクテリウム、ブドウ球菌、マラセチア属の生菌数が測定されました。その結果、開放面皰の97%に微生物が検出されましたが、いずれのサイトカイン、特にインターロイキン1α様生物活性と微生物数との間には有意な相関が認められませんでした【文献5】。この知見は、面皰内のインターロイキン1α産生が必ずしも細菌数に依存しないことを示唆しており、炎症反応の開始機構がより複雑であることを示しています。
- 開放面皰の97%に微生物が検出されましたが、微生物数とインターロイキン1α様生物活性との間には有意な相関がありませんでした【文献5】。
- 生物活性を持つインターロイキン1βはいずれの面皰からも検出されませんでした【文献5】。
- 生物活性を持つTNFαは3個の面皰でのみ検出され、さらに5個の面皰で免疫化学的TNFαが検出されました【文献5】。
- 面皰内のインターロイキン1α産生は細菌数以外の因子によって制御されている可能性があります。
- 炎症イベントは面皰病変の開始に関与しています【文献3】。
微生物数とサイトカイン濃度との間に相関がないという発見は、白ニキビの病態理解において重要な意味を持ちます。これは、炎症反応の開始が単純な細菌感染ではなく、より複雑な機序によって制御されていることを示唆しています。面皰内の微小環境、特に機械的ストレス、化学的刺激、皮脂の質的変化などが、角化細胞からのインターロイキン1α放出を誘導している可能性があります。実際、皮脂脂質の質的変化は角化細胞の分化を変化させ、インターロイキン1の分泌を誘導し、毛包過角化の発生に寄与することが報告されています【文献2】。
インターロイキン1αによる過角化の誘導
インターロイキン1αは、毛包漏斗部における過角化を誘導する重要な因子です。インターロイキン1αは角化細胞の増殖と分化に直接的な影響を及ぼし、面皰形成における中心的な役割を果たします。実験的研究では、インターロイキン1αへの曝露により、単離された毛包漏斗部および毛包脂腺系においてin vitroで面皰形成が誘導されることが示されています【文献6】。インターロイキン1αは毛包漏斗部においてin vitroおよびin vivoで過角化を誘導することが報告されています【文献2】。
- インターロイキン1αは毛包漏斗部においてin vitroおよびin vivoで過角化を誘導します【文献2】。
- 単離された毛包漏斗部および毛包脂腺系において、インターロイキン1α曝露により面皰形成が誘導されます【文献6】。
- インターロイキン1αは過角化を刺激し、面皰の形成を促進します【文献6】。
- 皮脂脂質の質的変化は角化細胞の分化を変化させ、インターロイキン1の分泌を誘導し、毛包過角化の発生に寄与します【文献2】。
- 炎症イベントは面皰病変の開始に関与しています【文献3】。
インターロイキン1αによる過角化誘導のメカニズムは、複数の経路を介して作用します。このサイトカインは角化細胞の増殖を促進するとともに、分化過程を修飾します。角化細胞の増殖亢進は、3H-チミジン標識の増加およびKi-67標識指数の上昇によって確認されています【文献1】【文献4】。さらに、異常な毛包漏斗部角化は、毛包漏斗部角化細胞の末端分化の障害と関連しており、これはフィラグリン発現の増加と関連しています【文献2】。このように、インターロイキン1αは白ニキビにおける角化異常の形成において中心的な役割を果たしています。
Toll様受容体を介した炎症反応の始動
Toll様受容体は、病原体関連分子パターンを認識する受容体ファミリーであり、自然免疫応答の開始において中心的な役割を果たします。Toll様受容体は、微生物が提示する病原体関連分子パターンを認識する分子ファミリーであり、抗菌化合物とサイトカインの放出で終結するシグナル伝達カスケードを開始します【文献6】。アクネ菌は皮脂腺にコロニー形成し、Toll様受容体の活性化を介してインターロイキン1αを含む炎症性サイトカインを放出するよう毛包漏斗部角化細胞を刺激します【文献6】。アクネ菌は、Toll様受容体2に作用することにより、毛包角化細胞によるインターロイキン6やインターロイキン8などのサイトカインの分泌、およびマクロファージにおけるインターロイキン8と12の分泌を刺激し、炎症を引き起こす可能性があります【文献2】。
Toll様受容体2は、アクネ菌の細胞壁成分であるペプチドグリカンを認識し、角化細胞からのインターロイキン1α放出を誘導します。正常な増殖期静止期のアクネ菌は、Toll様受容体2を介して正常ヒト表皮角化細胞を直接活性化し、インターロイキン1αの放出を刺激します【文献6】。一次培養角化細胞をToll様受容体2アゴニストで処理すると、インターロイキン1αの放出が誘発されることが確認されており、これは以前に発表された結果を確認するものです【文献6】。これは翻訳後イベントである可能性が高く、以前の観察では微生物による刺激は角化細胞におけるインターロイキン1αの合成を刺激できないことが示されています【文献6】。
Toll様受容体活性化による面皰形成モデル
Toll様受容体の活性化とニキビのライフサイクルに関するモデルが提唱されています【文献6】。このモデルによれば、(A)アクネ菌が皮脂腺にコロニー形成し、Toll様受容体の活性化を介してインターロイキン1αを含む炎症性サイトカインを放出するよう毛包漏斗部角化細胞を刺激します。(B)インターロイキン1αを含む炎症性サイトカインは過角化を刺激し、面皰の形成を促進します。(C)インターロイキン1αを含む炎症性サイトカインの分泌は、基底層皮脂細胞における脂質生成の減少とも関連しており、これにより皮脂レベルが低下し、アクネ菌の栄養源が枯渇します。(D)アクネ菌レベルの減少により炎症性サイトカイン分泌が減少し、面皰が消退し、皮脂細胞の成熟が回復します【文献6】。
- アクネ菌が皮脂腺にコロニー形成し、Toll様受容体活性化を介して毛包漏斗部角化細胞からインターロイキン1αを含む炎症性サイトカインを放出させます【文献6】。
- インターロイキン1αを含む炎症性サイトカインは過角化を刺激し、面皰の形成を促進します【文献6】。
- 炎症性サイトカイン分泌は基底層皮脂細胞における脂質生成の減少と関連し、皮脂レベルが低下してアクネ菌の栄養源が枯渇します【文献6】。
- アクネ菌レベルの減少により炎症性サイトカイン分泌が減少し、面皰が消退し、皮脂細胞の成熟が回復します【文献6】。
- Toll様受容体の活性化とインターロイキン1αの角化細胞からの分泌が、面皰形成における開始ステップであり、ニキビの病態生理において重要です【文献6】。
このモデルは、白ニキビの形成から消退までのライフサイクルを説明する包括的な枠組みを提供します。Toll様受容体の活性化とインターロイキン1αの角化細胞からの分泌が、面皰形成における開始ステップであり、したがってニキビの病態生理において重要です【文献6】。炎症イベントは面皰病変の開始に関与しており【文献3】、この知見は白ニキビの病態が単純な機械的閉塞ではなく、免疫学的・炎症性の要素を含む複雑なプロセスであることを示しています。
病原体関連分子パターンによる過角化の誘導
器官培養された毛包脂腺系を用いた実験では、病原体関連分子パターンによる処理が、インターロイキン1α曝露によって作られたものと類似した過角化パターンを引き起こすことが示されています。この過角化は、Toll様受容体2依存性およびToll様受容体4依存性のメカニズムの両方を介して生じます【文献6】。この発見は、アクネ菌の細胞壁成分が直接的に過角化を誘導する能力を持つことを示しており、面皰形成における病原体関連分子パターンの役割を実証しています。
- 器官培養された毛包脂腺系において、病原体関連分子パターン処理がインターロイキン1α曝露と類似した過角化パターンを誘導します【文献6】。
- 過角化はToll様受容体2依存性およびToll様受容体4依存性のメカニズムを介して生じます【文献6】。
- 一次培養角化細胞をToll様受容体2アゴニストで処理すると、インターロイキン1αの放出が誘発されます【文献6】。
- これは翻訳後イベントである可能性が高く、微生物による刺激は角化細胞におけるインターロイキン1αの合成を刺激できません【文献6】。
- アクネ菌は、Toll様受容体2に作用することにより、炎症性サイトカインの分泌を刺激します【文献2】。
Toll様受容体2アゴニストによるインターロイキン1α放出は、翻訳後イベントである可能性が高いことが示唆されています。以前の観察では、アクネ菌を含む微生物による刺激は角化細胞におけるインターロイキン1αの合成を刺激できないことが示されています【文献6】。このことは、Toll様受容体2の活性化が、既に細胞内に存在するインターロイキン1αの放出を促進するが、新たな合成は誘導しないことを示唆しています。このメカニズムは、アクネ菌刺激に対する角化細胞の迅速な応答を可能にし、白ニキビの形成初期段階における炎症反応の速やかな開始を説明しています。炎症イベントは面皰病変の開始に関与しており【文献3】、この炎症反応の始動機構が白ニキビの病態形成において極めて重要な役割を果たしています。
白ニキビ形成における皮脂組成異常の役割
白ニキビの形成において、皮脂は単なる量的な問題ではなく、その質的な変化が重要な役割を果たします。皮脂は、トリグリセリド、ワックスエステル、スクアレン、遊離脂肪酸、コレステロールなどの複雑な脂質混合物であり、皮脂腺細胞の分化と脂質合成の過程で産生されます。ニキビ患者の皮脂では、脂肪酸の種類と配列における変化が観察されており、特にリノール酸のレベルが低下していることが報告されています。リノール酸の枯渇は毛包過角化に寄与し、これは面皰形成における重要なステップです。さらに、表皮バリア機能の障害も引き起こし、面皰壁の炎症性メディエーターに対する透過性を増加させる可能性があります【文献7】。
リノール酸は必須脂肪酸であり、ヒトの皮脂中に存在する主要な多価不飽和脂肪酸です。実験モデルでは、リノール酸のβ酸化は特定の皮脂腺脂質産生、特にワックスエステルと相関しており、したがって皮脂細胞の機能および分化と関連しています。皮脂中のリノール酸量の減少は、毛包におけるスフィンゴ脂質の組成に影響を与えることが示唆されています。ニキビ患者は、リノール酸を含むアシルセラミドの割合が低いことが示されています。スフィンゴ脂質におけるリノール酸の枯渇は、面皰形成に関与する重要なイベントである毛包過角化に関与していると仮説されています【文献7】。さらに、リノール酸の低レベルは、表皮バリア機能の障害を引き起こし、面皰壁の炎症性物質に対する透過性の増加を招きます【文献7】。
皮脂組成の異常は、単にリノール酸の減少にとどまらず、脂質過酸化産物の蓄積も含まれます。特に、スクアレン過酸化物は、炎症反応の発生と細胞毒性および面皰形成において重要な役割を果たすことが認識されています【文献7】。スクアレンはヒト皮脂腺分泌物に特有の脂質であり、皮膚表面において酸化ストレスに曝露されると過酸化物を形成します。これらの過酸化物は、角化細胞の増殖を促進し、炎症性メディエーターの放出を誘導することで、白ニキビの形成と進展に寄与します。このように、皮脂組成の質的変化は、白ニキビの病態形成において多面的な役割を果たしています。
リノール酸欠乏と毛包過角化
リノール酸は必須脂肪酸であり、正常な皮膚機能の維持に不可欠です。ニキビは毛包上皮の過角化を特徴とし、休眠状態の開放または閉鎖面皰として存在するか、毛包の炎症を引き起こす可能性のある角質性詰まりを引き起こします。ニキビ患者は一貫して皮脂分泌レベルの上昇が観察されていますが、皮脂分泌率を面皰形成に関連付ける機序は知られていません。ニキビ患者はまた、皮膚表面脂質中のリノール酸レベルが低いことが示されています【文献8】。この観察を説明するために、ヒト皮脂中のリノール酸濃度は、各皮脂腺細胞の分化開始時に存在するリノール酸の量と、その後の各皮脂腺細胞における内因性脂質合成によってこの初期量が希釈される程度に依存するという仮説が提唱されています【文献8】。
この仮説の帰結として、皮脂中の低濃度のリノール酸が毛包上皮の細胞に必須脂肪酸欠乏状態を課し、ニキビに特徴的な過角化を誘導するという仮説が保持されています【文献8】。実験モデルでは、リノール酸は皮脂腺において優先的にβ酸化によって2炭素前駆体に変換され、アセチル-CoAを生成します。この産物は、スクアレンおよびワックスエステル合成につながる生合成経路に供給されます。リノール酸のβ酸化は皮脂細胞に特異的であり、それらの分化と相関しているようです。リノール酸量の減少は、面皰形成を促進する因子として提唱されています【文献9】。
皮脂腺におけるリノール酸代謝
皮脂腺細胞は、脂肪酸を選択的に利用することが知られており、リノール酸のみがβ酸化を受けるように見えます。実験データによれば、リノール酸はアシル側鎖においてβ酸化反応に入り、アセチル-CoAを生成する2炭素前駆体に優先的に変換されます。この産物は、スクアレンおよびワックスエステル合成につながる生合成経路に供給されます【文献9】。リノール酸のβ酸化は皮脂細胞に特異的であり、それらの分化と相関しているようです【文献9】。この代謝経路の特異性は、皮脂分泌が亢進した際にリノール酸濃度が相対的に低下する機序を説明しています。
- リノール酸は皮脂腺においてβ酸化を受け、アセチル-CoAを生成する2炭素前駆体に変換されます【文献9】。
- この産物はスクアレンおよびワックスエステル合成につながる生合成経路に供給されます【文献9】。
- リノール酸のβ酸化は皮脂細胞に特異的であり、それらの分化と相関しています【文献9】。
- 皮脂分泌の増加により、各皮脂腺細胞における内因性脂質合成がリノール酸を希釈します【文献8】。
- その結果、皮脂中および毛包上皮内のリノール酸濃度が相対的に低下します。
皮脂中のリノール酸濃度の低下機序は、希釈効果として説明されます。各皮脂腺細胞が分化を開始する時点で含有するリノール酸の量は限られており、その後の細胞内での内因性脂質合成により、このリノール酸が希釈されます【文献8】。皮脂分泌が亢進しているニキビ患者では、この希釈効果がより顕著となり、結果として皮脂中のリノール酸濃度がさらに低下します。この低濃度のリノール酸は、毛包漏斗部の角化細胞に供給されるリノール酸量を減少させ、これらの細胞に必須脂肪酸欠乏状態を引き起こします【文献8】。
リノール酸欠乏による角化異常の機序
皮脂中の低濃度のリノール酸が毛包上皮の細胞に必須脂肪酸欠乏状態を課し、ニキビに特徴的な過角化を誘導すると仮説されています【文献8】。リノール酸は、毛包漏斗部においてスフィンゴ脂質に取り込まれ、特にアシルセラミドの構成成分として重要です。皮脂中のリノール酸量の減少は、毛包におけるスフィンゴ脂質の組成に影響を与えることが示唆されています。ニキビ患者は、リノール酸を含むアシルセラミドの割合が低いことが示されています【文献7】。
- 皮脂中の低濃度リノール酸が毛包上皮細胞に必須脂肪酸欠乏状態を課します【文献8】。
- ニキビ患者はリノール酸を含むアシルセラミドの割合が低いことが示されています【文献7】。
- スフィンゴ脂質におけるリノール酸の枯渇は毛包過角化に関与していると仮説されています【文献7】。
- リノール酸の低レベルは表皮バリア機能の障害を引き起こします【文献7】。
- バリア機能の障害は面皰壁の炎症性物質に対する透過性の増加を招きます【文献7】。
スフィンゴ脂質におけるリノール酸の枯渇は、面皰形成に関与する重要なイベントである毛包過角化に関与していると仮説されています【文献7】。セラミドは角質層のバリア機能において中心的な役割を果たしており、特にリノール酸を含むアシルセラミドは、角質細胞間脂質の構造と機能に不可欠です。リノール酸を含むセラミドの減少は、角質細胞間の凝集性を亢進させ、正常な細胞剥離を妨げます。さらに、リノール酸の低レベルは表皮バリア機能の障害を引き起こし、面皰壁の炎症性物質に対する透過性の増加を招きます【文献7】。この透過性の増加は、毛包内容物が真皮内へ漏出した際の炎症反応を増強し、白ニキビから炎症性病変への移行を促進します。
スクアレン過酸化と炎症反応
スクアレンはヒト皮脂腺分泌物に特有の脂質であり、ヒトの皮脂において約12〜15%を占めます。スクアレンは皮膚表面において保護作用と柔軟作用を提供すると考えられています。ニキビ患者は、皮脂中に正常よりも高レベルのスクアレンを産生することが示されており、スクアレンはニキビの発生に直接寄与すると疑われています。面皰の発生に役割を果たすことが提唱されている脂質の中で、特に脂質過酸化産物に注目が集まっています。最近の研究では、脂質過酸化物の蓄積が面皰における炎症性変化の原因である可能性が実証されています【文献7】。
スクアレンは環境酸化ストレス因子、例えば汚染や太陽からの紫外線に曝露されると、脂質過酸化として知られるプロセスにおいて反応すると考えられています。このプロセスでは、スクアレンなどの表皮脂質が酸化され、反応性の高い炎症性化合物が生成されます。スクアレンが環境酸化ストレスに曝露されると、スクアレン過酸化物に変換され、これがニキビに特徴的な炎症カスケードを駆動します。面皰形成における脂質過酸化産物、特にスクアレン過酸化物は、炎症反応の発生と細胞毒性および面皰形成において重要な役割を果たすことが認識されています【文献7】。
スクアレン過酸化物の生成と蓄積
スクアレンの過酸化は、皮膚表面において環境要因により引き起こされます。紫外線、汚染物質、その他の酸化ストレス因子がスクアレンと反応し、スクアレンモノヒドロペルオキシドなどの過酸化物を生成します。これらの過酸化物は、正常なスクアレンやスクアレンの完全飽和型であるスクアランとは異なり、強力な生物学的活性を持ちます。実験的研究では、スクアレンモノヒドロペルオキシドの局所適用により、ウサギの耳において著しい過形成と毛包漏斗部上皮の過角化、および皮脂腺の著しい増殖が観察されました【文献9】。
- スクアレンは環境酸化ストレス因子により脂質過酸化を受けます。
- スクアレンモノヒドロペルオキシドなどの過酸化物が生成されます。
- スクアレンモノヒドロペルオキシドは過形成と毛包漏斗部上皮の過角化を引き起こします【文献9】。
- スクアレン過酸化物は炎症反応の発生と細胞毒性および面皰形成において重要な役割を果たします【文献7】。
- 脂質過酸化物の蓄積が面皰における炎症性変化の原因である可能性があります【文献7】。
スクアレンモノヒドロペルオキシドは、面皰形成に特異的に関与していることが示されています。完全飽和型のスクアランや合成過酸化物は、無視できる程度の面皰形成効果しか示さず、皮膚の粗さやしわを引き起こさなかったことから、スクアレンモノヒドロペルオキシドが観察された皮膚変化に特異的に関与していることが示されています【文献9】。さらに、in vitroデータでは、スクアレン過酸化物がHaCaT角化細胞の増殖誘導を超えて、炎症性メディエーターの上方制御と放出も引き起こし、スクアレン酸化副産物の炎症促進活性を示しています【文献9】。
スクアレン過酸化物による炎症性メディエーターの誘導
スクアレン過酸化物は、角化細胞において炎症性メディエーターの産生を誘導します。in vitro研究では、スクアレン過酸化物がHaCaT角化細胞の増殖を誘導するだけでなく、炎症性メディエーターの上方制御と放出も引き起こすことが示されており、これはスクアレン酸化副産物の炎症促進活性を示しています【文献9】。特に、脂質過酸化の程度、インターロイキン1α、およびNF-κB含量が、非炎症性病変よりも炎症性病変において高いことが観察されています【文献7】。
- スクアレン過酸化物はHaCaT角化細胞の増殖を誘導します【文献9】。
- 炎症性メディエーターの上方制御と放出を引き起こします【文献9】。
- 脂質過酸化の程度、インターロイキン1α、NF-κB含量が炎症性病変で高くなっています【文献7】。
- ニキビ皮脂は対照被験者の皮脂と比較して高レベルのスクアレン過酸化物を示します【文献9】。
- ビタミンEの減少量がスクアレン過酸化の程度の増加と関連しています【文献9】。
ニキビ皮脂は対照被験者の皮脂と比較して高レベルのスクアレン過酸化物を示します。さらに、ビタミンEの減少量がスクアレン過酸化の程度の増加と関連していました【文献9】。これらの知見は、若年性ニキビに対して強調されており、実際、若年性ニキビはより大きな炎症性を持っています【文献9】。皮膚が過酸化されたスクアレンの潜在的に有害な影響を制限するために採用する戦略は、皮膚表面へのビタミンE供給に依存しています。ビタミンEは、ヒト皮脂の重要な構成成分として皮膚表面脂質に見られます【文献9】。このように、スクアレン過酸化と抗酸化防御のバランスが、白ニキビにおける炎症反応の程度を決定する重要な因子となっています。
白ニキビにおける角化細胞間接着の異常
白ニキビの形成において、角化細胞間の接着異常は過角化と並んで重要な病態です。ニキビに罹患した毛包の角化細胞は、より多くのデスモソームとトノフィラメントを有しており、その結果、より厚く、より凝集性の高い角質層を形成します。デスモソームは主に表皮に見られる特殊な細胞間結合であり、2つの外側細胞膜をトノフィラメントとしても知られる中間径ケラチンフィラメントとともに結合します。角化細胞におけるデスモソームとトノフィラメントの増加は、正常な細胞剥離を妨げ、毛包内腔における角質栓の形成を促進します。
角化細胞の保持型過角化は、角化細胞または毛包の皮膚細胞が凝集性を持ち、皮膚表面で正常に剥離しないときに発生します。この異常な剥離は、ニキビ病変が皮膚表面に見えるようになる8週間前に、皮膚の下に微小面皰の形成につながります。管腔過角化は2つの主要な因子により生じる可能性があります。すなわち、管腔角化細胞の過剰増殖、これは角化細胞の異常な剥離であるか、または管腔角質細胞の分離の減少が毛包内の細胞の凝集につながります。ニキビ患者は上皮の剥離に変化を示しています。
角質層は皮膚の最外層であり、ケラチンを含む角化細胞または死んだ皮膚細胞から構成されます。ニキビの超微形態学的変化では、ケラチンの変化が最初に毛包漏斗部の下部で観察され、その後毛包全体で観察されます。角質物質は緻密になり、細胞内脂肪滴が蓄積し、ケラトヒアリン顆粒の数とサイズが増加し、層板顆粒が減少し、これが面皰の形成につながります。また、面皰における角化細胞の増殖は正常毛包と比較して高く、毛包漏斗部角化細胞はより凝集性が高い状態です。このように、角化細胞間接着の異常は、白ニキビの形成における重要な構成要素です。
デスモソームの構造と機能
デスモソームは、角化細胞間の機械的結合を担う細胞間接着構造です。デスモソームは、デスモグレイン、デスモコリン、プラコグロビン、デスモプラキン、プラコフィリンなどの複数のタンパク質から構成される複合体です。これらのタンパク質は細胞膜を貫通し、細胞外ドメインで隣接細胞のデスモソームタンパク質と結合し、細胞内ドメインでケラチン中間径フィラメントと連結します。正常な表皮では、デスモソームは角化細胞間の強固な接着を提供するとともに、細胞の分化と移動に応じて動的に再編成されます。
デスモソーム構成成分は、角化細胞が分化し層状化するにつれて変化します。例えば、デスモグレイン2は基底増殖層に集中しているのに対し、デスモグレイン1は細胞が基底層から移行するときに最初に発現し、層状化の間に上層において徐々に集中します。異なるデスモソームカドヘリンは、接着強度に固有の差異を持っています。したがって、各層における構成成分の切り替えは、下層の増殖層における細胞の可塑性と、上層における強度とバリア機能の増加を可能にする可能性があります。デスモソームの構成成分は、接着機能に加えて、細胞内シグナル伝達を制御します。
白ニキビにおけるデスモソームの増加
ニキビに罹患した毛包の角化細胞は、より多くのデスモソームとトノフィラメントを有しており、その結果、より厚く、より凝集性の高い角質層を形成します。角化細胞におけるデスモソームの数と大きさの増加は、細胞間接着を異常に強化し、正常な細胞剥離を妨げます。この変化は、角化細胞が毛包内腔に蓄積し、角質栓を形成する直接的な原因となります。デスモソームの増加は、単なる量的な変化ではなく、その機能状態の変化も伴っている可能性があります。
- ニキビに罹患した毛包の角化細胞はより多くのデスモソームとトノフィラメントを有します。
- デスモソームの増加により、より厚く、より凝集性の高い角質層が形成されます。
- 細胞間接着の異常な強化により、正常な細胞剥離が妨げられます。
- デスモソームとケラチン中間径フィラメントの結合が強化され、細胞骨格構造が硬化します。
- 角化細胞の凝集性亢進により、毛包内腔での角質栓形成が促進されます。
デスモソームの増加は、複数の因子によって調節されています。インターロイキン1αなどの炎症性サイトカインは、デスモソーム構成タンパク質の発現を促進する可能性があります【文献2】。さらに、カルシウム濃度の変化もデスモソーム形成に影響を及ぼします。カルシウムは細胞外だけでなく細胞内においても重要なシグナル分子であり、カルシウム依存性の転写因子を活性化してデスモソームタンパク質の発現を促進します。白ニキビでは、これらの因子が複合的に作用することで、デスモソームの過剰発現が生じ、異常に強固な細胞間接着が形成されます。
トノフィラメントの過剰発達
トノフィラメントはケラチン中間径フィラメントの別名であり、細胞骨格の主要な構成要素です。トノフィラメントはデスモソームと結合し、細胞間接着に機械的強度を提供します。ニキビに罹患した毛包の角化細胞では、トノフィラメントの密度が増加しており、細胞骨格がより緻密な構造を形成しています。この変化は、角化細胞の機械的強度を増加させる一方で、細胞の柔軟性を低下させ、正常な細胞剥離を妨げます。
- トノフィラメントの密度が増加し、細胞骨格がより緻密な構造を形成します。
- ケラチン中間径フィラメントとデスモソームの結合が強化されます。
- 細胞骨格の緻密化により、角化細胞の機械的強度が増加します。
- 細胞の柔軟性が低下し、正常な細胞剥離が障害されます。
- 中間径フィラメント網の変化は、細胞内小器官の配置にも影響を及ぼします。
トノフィラメントの過剰発達は、ケラチン遺伝子の発現変化によって引き起こされます。特定のケラチンの過剰発現は、中間径フィラメント網の密度を増加させ、細胞骨格を強化します。さらに、トノフィラメントの翻訳後修飾、特にリン酸化も、フィラメントの集合と安定性を制御します。白ニキビでは、これらの制御機構に異常が生じており、トノフィラメントの過剰な蓄積と安定化が起こります。この結果、角化細胞は異常に硬い構造を持ち、毛包内腔での剥離が障害されます。
角質細胞間脂質の異常
角質細胞間脂質は、角質層のバリア機能と角質細胞の正常な剥離に不可欠です。角質細胞間脂質は、セラミド、コレステロール、遊離脂肪酸から構成され、これらが特定の比率で配列することで、角質層の脂質ラメラ構造を形成します。白ニキビでは、層板顆粒の減少により、角質細胞間脂質の産生が低下しています【文献2】。層板顆粒は角質細胞間脂質の前駆体を含む細胞小器官であり、顆粒層で細胞外へ放出されることで角質層の脂質バリアを形成します。
特に、リノール酸を含むセラミドの減少は、白ニキビにおける重要な変化です。ニキビ患者は、リノール酸を含むアシルセラミドの割合が低いことが示されています【文献7】。スフィンゴ脂質におけるリノール酸の枯渇は、面皰形成に関与する重要なイベントである毛包過角化に関与していると仮説されています【文献7】。セラミドは角質層のバリア機能において中心的な役割を果たしており、リノール酸を含むアシルセラミドは、角質細胞間脂質の構造と機能に不可欠です。リノール酸を含むセラミドの減少は、角質細胞間の凝集性を亢進させ、正常な細胞剥離を妨げます。
層板顆粒の減少とその影響
層板顆粒は、顆粒層の角化細胞に存在する特徴的な細胞小器官です。層板顆粒は、脂質とタンパク質を含む層状構造を持ち、角化細胞の最終分化段階で細胞外へ放出されます。放出された層板顆粒の内容物は、角質細胞間空間で再編成され、角質細胞間脂質のラメラ構造を形成します。白ニキビでは、層板顆粒の数が減少しており、これが角質細胞間脂質の産生低下をもたらします【文献2】。
- 層板顆粒の数が減少し、角質細胞間脂質の産生が低下します【文献2】。
- 角質細胞間脂質の減少により、角質層のバリア機能が障害されます。
- バリア機能の低下は、毛包壁の透過性を増加させます。
- リノール酸を含むセラミドの減少が特に顕著です【文献7】。
- 角質細胞間脂質の異常は、正常な細胞剥離を妨げ、凝集性を亢進させます。
層板顆粒の減少機序は完全には解明されていませんが、複数の因子が関与していると考えられます。リノール酸の欠乏は、層板顆粒の形成を抑制する可能性があります。リノール酸は、セラミド合成の基質として必要であり、その欠乏はセラミド産生を低下させます。さらに、炎症性サイトカインも層板顆粒の形成に影響を及ぼす可能性があります。白ニキビでは、これらの因子が複合的に作用することで、層板顆粒の減少が生じ、角質細胞間脂質の産生が障害されます。この結果、角質細胞間の凝集性が亢進し、正常な細胞剥離が妨げられます。
セラミド組成の変化
セラミドは、角質細胞間脂質の主要な構成成分であり、複数のサブタイプが存在します。ヒトの角質層には、少なくとも12種類のセラミドサブタイプが同定されており、それぞれが特有の構造と機能を持っています。ニキビ患者では、セラミド組成に変化が認められており、特にリノール酸を含むアシルセラミド(セラミド1)の割合が低下しています【文献7】。アシルセラミドは、極めて長鎖のω-ヒドロキシ脂肪酸にリノール酸がエステル結合した特殊な構造を持ちます。
- ニキビ患者はリノール酸を含むアシルセラミドの割合が低いことが示されています【文献7】。
- アシルセラミドの減少は、角質層のバリア機能を低下させます。
- 皮脂由来の脂肪酸が面皰のアシルセラミドに取り込まれ、リノール酸を置換します。
- セラミド組成の変化は、角質細胞間脂質のラメラ構造を変化させます。
- ラメラ構造の異常は、角質細胞の剥離を障害します。
面皰のアシルセラミドは、皮膚表面のアシルセラミドと比較して、16:0、16:1δ6、18:1δ6+δ8の割合が高く、リノール酸(18:2δ9,12)がはるかに少ないことが示されています。面皰からの遊離脂肪酸も単離および分析され、面皰のアシルセラミドのエステル化脂肪酸と非常に類似した組成を持っていました。これらの結果は、皮脂由来の脂肪酸が面皰のアシルセラミドに取り込まれ、リノール酸を置換することを確認しています。このプロセスは、皮膚表面の表皮のアシルセラミドにも影響を及ぼし、ニキビ患者では正常被験者よりも顕著です。このように、セラミド組成の変化は、白ニキビにおける角化異常の重要な要素です。
まとめ
白ニキビ、すなわち閉鎖面皰は、臨床的には非炎症性皮疹として分類されながらも、その形成過程には極めて複雑な病態生理学的機序が関与しています。本記事で詳述したように、白ニキビの形成は単純な毛孔の機械的閉塞ではなく、角化細胞の増殖異常、角質細胞間の凝集性亢進、皮脂組成の質的変化、炎症性メディエーターの産生、そして角化細胞間接着構造の異常という、多層的かつ相互に関連する病態の統合的な結果として理解されるべきです。
毛包漏斗部における角化細胞の増殖亢進は、3H-チミジン標識およびKi-67標識指数の上昇によって実証されており、これが白ニキビ形成の最も重要な初期イベントです【文献1】【文献4】。この増殖亢進に加えて、角化細胞間の凝集性が著しく亢進しており、デスモソームとトノフィラメントの増加により、角質細胞が毛包内腔に異常に蓄積します。さらに、層板顆粒の減少により角質細胞間脂質の産生が低下し、これが正常な細胞剥離をさらに障害します【文献2】。
皮脂組成の質的変化、特にリノール酸の枯渇は、毛包過角化の誘導において中心的な役割を果たします【文献7】【文献8】。リノール酸の欠乏は、スフィンゴ脂質の組成を変化させ、特にリノール酸を含むアシルセラミドの減少をもたらします【文献7】。この変化は、毛包上皮細胞に必須脂肪酸欠乏状態を課し、角化異常を引き起こします【文献8】。さらに、スクアレン過酸化物の蓄積は、炎症性メディエーターの産生を誘導し、白ニキビの病態を増悪させます【文献7】【文献9】。
炎症性メディエーター、特にインターロイキン1αは、白ニキビの形成初期段階から重要な役割を果たしています。面皰の76%において生物活性を持つインターロイキン1α様物質が検出されており【文献5】、このサイトカインは毛包漏斗部において過角化を誘導します【文献2】【文献6】。アクネ菌は、Toll様受容体2を介して角化細胞を刺激し、インターロイキン1αの放出を促進します【文献6】。このように、白ニキビにおける炎症反応は、病変形成の初期から存在し、その後の病態進展に決定的な役割を果たしています【文献3】。
白ニキビの病態理解は、この数十年間で大きく進展しましたが、依然として解明されていない部分も多く残されています。角化細胞の増殖を制御する分子機構、デスモソームの発現と機能を調節するシグナル伝達経路、皮脂組成が角化細胞に及ぼす影響の詳細など、さらなる研究が必要とされる領域は広範囲にわたります。しかしながら、本記事で概説した知見は、白ニキビの病態生理の本質を理解するための堅固な基盤を提供するものであり、この複雑な皮膚疾患の科学的理解を深化させる一助となることを期待します。
専門用語一覧
- 毛包脂腺系(もうほうしせんけい):毛包、皮脂腺、毛幹から構成される皮膚の構造単位です。
- 毛包漏斗部(もうほうろうとぶ):毛包の上部で皮膚表面に開口する部分です。白ニキビでは、この部位で角化細胞の過剰増殖が最初に観察されます。
- 過角化(かかくか):角化細胞の過剰な増殖と蓄積です。白ニキビ形成の中心的病態となります。
- 保持型過角化:角化細胞が正常に剥離せず、管腔内に保持・蓄積される異常な角化様式です。電子顕微鏡的には、ケラトヒアリン顆粒の増加、脂肪滴の蓄積、扁平上皮の自己折り畳み像として観察されます。白ニキビに特徴的な病態です。
- ケラトヒアリン顆粒:顆粒層の角化細胞に存在する細胞内顆粒です。フィラグリンなどのタンパク質を含み、角化過程において重要な役割を果たします。白ニキビでは、この顆粒の数とサイズが増加します。
- 層板顆粒(そうばんかりゅう):顆粒層の角化細胞に存在する細胞小器官です。角質細胞間脂質の前駆体を含み、細胞外へ放出されることで角質層の脂質バリアを形成します。白ニキビでは、この顆粒が減少しています。
- デスモソーム:角化細胞間の主要な接着構造です。デスモグレイン、デスモコリンなどの膜貫通タンパク質が隣接細胞と結合し、細胞内ではケラチン中間径フィラメントと連結して機械的強度を提供します。白ニキビでは、デスモソームの数と大きさが増加します。
- トノフィラメント:ケラチン中間径フィラメントの別名です。細胞骨格の主要構成要素で、デスモソームと結合して細胞間接着に機械的強度を提供します。
- 中間径フィラメント:細胞骨格を構成する線維状構造の一種です。ケラチンから形成され、約10nmの直径を持ちます。
- デスモグレイン:デスモソームを構成するカドヘリン型接着分子です。細胞間接着を担います。
- デスモコリン:デスモソームを構成するカドヘリン型接着分子です。デスモグレインとともに細胞間接着を担います。
- プラコグロビン:デスモソームの細胞内プラーク領域を構成するタンパク質です。
- デスモプラキン:デスモソームの細胞内プラーク領域を構成するタンパク質です。ケラチンフィラメントと結合します。
- プラコフィリン:デスモソームの細胞内プラーク領域を構成するタンパク質です。
- β酸化(べーたさんか):脂肪酸が2炭素単位ずつ分解されてアセチル-CoAを生成する代謝経路です。皮脂腺では、リノール酸が選択的にβ酸化を受け、スクアレンやワックスエステルの合成に利用されます。
- アセチル-CoA:脂肪酸のβ酸化により生成される2炭素単位の代謝産物です。スクアレンやワックスエステルの生合成に利用されます。
- インターロイキン1α(IL-1α):角化細胞が産生する強力な炎症性サイトカインです。角化細胞の増殖・分化を調節し、過角化を誘導します。白ニキビの76%で検出されており、面皰形成の初期段階から重要な役割を果たします。
- インターロイキン1β(IL-1β):炎症性サイトカインの一種です。インターロイキン1αと類似の作用を持ちますが、白ニキビではほとんど検出されません。
- インターロイキン6(IL-6):炎症性サイトカインの一種です。急性期反応を誘導します。
- インターロイキン8(IL-8):ケモカインの一種です。好中球の走化性を誘導します。
- TNFα(腫瘍壊死因子α):強力な炎症性サイトカインです。炎症反応の増幅に関与します。
- ケモカイン:白血球の走化性を誘導するサイトカインの総称です。インターロイキン8が代表例です。
- Toll様受容体(とーるようじゅようたい):病原体関連分子パターンを認識する受容体ファミリーです。自然免疫応答の開始において中心的役割を果たします。アクネ菌の細胞壁成分を認識し、炎症性サイトカインの産生を誘導します。
- Toll様受容体2(TLR2):グラム陽性菌の細胞壁成分であるペプチドグリカンやリポテイコ酸を認識するToll様受容体です。アクネ菌による炎症反応の始動に重要な役割を果たします。
- Toll様受容体4(TLR4):グラム陰性菌のリポ多糖を認識するToll様受容体です。
- 病原体関連分子パターン(PAMP):微生物が持つ保存された分子構造です。Toll様受容体により認識され、自然免疫応答を開始します。
- NF-κB(えぬえふかっぱーびー):炎症性遺伝子の転写を制御する転写因子です。Toll様受容体シグナルにより活性化され、インターロイキンなどの炎症性サイトカインの産生を誘導します。
- AP-1:炎症性遺伝子の転写を制御する転写因子です。細胞増殖や分化にも関与します。
- Ki-67:細胞増殖マーカーです。細胞周期のG1、S、G2、M期に発現する核抗原で、増殖している細胞を検出するために用いられます。
- Ki-67標識指数:Ki-67抗原陽性細胞の割合です。細胞増殖の活発さを示す指標で、白ニキビでは正常毛包よりも高値を示します。
- 3H-チミジン標識:放射性同位体(トリチウム)で標識されたチミジンを用いてDNA合成期の細胞を検出する方法です。細胞増殖の評価に用いられます。
- フィラグリン:ケラトヒアリン顆粒の主要構成タンパク質です。ケラチンフィラメントを凝集させ、角化細胞の分化において重要な役割を果たします。
- インボルクリン:角化外膜の構成タンパク質です。
- ロリクリン:角化外膜の主要構成タンパク質です。
- コルネオデスモソーム:角質層におけるデスモソームの修飾型です。角質細胞間の接着を担います。
- コルネオデスモシン:コルネオデスモソームの構成タンパク質です。角質細胞間接着を強化します。
- 過接着(ハイパーアドヒージョン):デスモソームが通常以上に強固な接着状態になり、細胞外カルシウム除去によっても接着が維持される状態です。
- 膠原線維(こうげんせんい):コラーゲンから構成される線維です。真皮の主要構成要素で、皮膚に強度を提供します。
- 瘢痕(はんこん):創傷治癒後に形成される線維性組織です。
- 海綿状変化(かいめんじょうへんか):組織が水腫状に腫脹し、細胞間隙が拡大する変化です。
- 走化性(そうかせい):化学物質の濃度勾配に従って細胞が移動する性質です。ケモカインが白血球の走化性を誘導します。
- アナフィラトキシン:補体活性化により生成される炎症性メディエーターです。C3a、C5aが血管透過性亢進や白血球走化性誘導を引き起こします。
- エイコサノイド:アラキドン酸から生合成される脂質メディエーターの総称です。プロスタグランジン、ロイコトリエン、リポキシンなどを含み、炎症反応を調節します。
- プロスタグランジン:シクロオキシゲナーゼによりアラキドン酸から生合成される脂質メディエーターです。血管拡張、発痛、炎症反応の調節に関与します。
- ロイコトリエン:リポキシゲナーゼによりアラキドン酸から生合成される脂質メディエーターです。気管支収縮、血管透過性亢進、白血球走化性誘導に関与します。
- サイクリックAMP(cAMP):細胞内セカンドメッセンジャーです。プロテインキナーゼAを活性化し、多様な細胞機能を制御します。
- プロモーター領域:遺伝子の転写開始点の上流に位置するDNA配列です。転写因子が結合して転写を制御します。
- アダプター分子:シグナル伝達において、受容体と下流のシグナル分子を仲介するタンパク質です。MyD88がToll様受容体のアダプター分子として機能します。
- MyD88:Toll様受容体のアダプター分子です。NF-κB経路の活性化に必須であり、炎症性サイトカインの産生誘導に重要な役割を果たします。
- MAPキナーゼ:細胞内シグナル伝達に関与するキナーゼファミリーです。細胞増殖、分化、アポトーシスを調節します。
- オートクライン:細胞が自ら分泌した物質により自身が刺激される様式です。
- パラクライン:細胞が分泌した物質により近傍の細胞が刺激される様式です。
- アゴニスト:受容体に結合して活性化し、生理的応答を引き起こす物質です。
- アンタゴニスト:受容体に結合するが活性化せず、アゴニストの作用を阻害する物質です。
参考文献
- Cunliffe WJ, Holland DB, Jeremy A. Comedone formation: etiology, clinical presentation, and treatment. Clin Dermatol. 2004;22(5):367-374.
- Kurokawa I, Danby FW, Ju Q, Wang X, Xiang LF, Xia L, Chen W, Nagy I, Picardo M, Suh DH, Ganceviciene R, Schagen S, Tsatsou F, Zouboulis CC. New developments in our understanding of acne pathogenesis and treatment. Exp Dermatol. 2009;18(10):821-832.
- Jeremy AHT, Holland DB, Roberts SG, Thomson KF, Cunliffe WJ. Inflammatory events are involved in acne lesion initiation. J Invest Dermatol. 2003;121(1):20-27.
- Knaggs HE, Holland DB, Morris C, Wood EJ, Cunliffe WJ. Quantification of cellular proliferation in acne using the monoclonal antibody Ki-67. J Invest Dermatol. 1994;102(1):89-92.
- Ingham E, Eady EA, Goodwin CE, Cove JH, Cunliffe WJ. Pro-inflammatory levels of interleukin-1 alpha-like bioactivity are present in the majority of open comedones in acne vulgaris. J Invest Dermatol. 1992;98(6):895-901.
- Selway JL, Kurczab T, Kealey T, Langlands K. Toll-like receptor 2 activation and comedogenesis: implications for the pathogenesis of acne. BMC Dermatol. 2013;13:10.
- Ottaviani M, Camera E, Picardo M. Lipid Mediators in Acne. Mediators Inflamm. 2010;2010:858176.
- Downing DT, Stewart ME, Wertz PW, Strauss JS. Essential fatty acids and acne. J Am Acad Dermatol. 1986;14(2 Pt 1):221-225.
- Picardo M, Ottaviani M, Camera E, Mastrofrancesco A. Sebaceous gland lipids. Dermatoendocrinol. 2009;1(2):68-71.
執筆者
中濵数理2-300x294.png)
■博士(工学)中濵数理
- 由風BIOメディカル株式会社 代表取締役社長
- 沖縄再生医療センター:センター長
- 一般社団法人日本スキンケア協会:顧問
- 日本再生医療学会:正会員
- 特定非営利活動法人日本免疫学会:正会員
- 日本バイオマテリアル学会:正会員
- 公益社団法人高分子学会:正会員
- X認証アカウント:@kazu197508